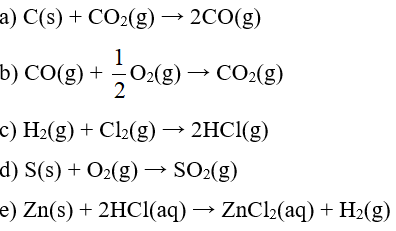Em hãy dự đoán phản ứng nào có ∆S > 0, ∆S < 0 và ∆S ≈ 0 Giải thích
Giải Chuyên đề Hóa học 10 Bài 4: Entropy và biến thiên năng lượng tự do Gibbs
Haylamdo biên soạn và sưu tầm lời giải Bài 2 trang 32 Chuyên đề Hóa học 10 trong Bài 4: Entropy và biến thiên năng lượng tự do Gibbs sách Chân trời sáng tạo. Với lời giải hay và chi tiết hy vọng sẽ giúp các học sinh dễ dàng nắm được cách làm bài tập trong Chuyên đề Hóa 10.
Bài 2 trang 32 Chuyên đề Hóa học 10: Em hãy dự đoán trong các phản ứng sau, phản ứng nào có ∆S > 0, ∆S < 0 và ∆S ≈ 0. Giải thích.
Lời giải:
- Các phản ứng hóa học làm tăng số mol khí thường có biến thiên entropy dương (∆S > 0).
- Các phản ứng hóa học làm giảm số mol khí thường có biến thiên entropy âm (∆S < 0)
- Các phản ứng hóa học không làm thay đổi số mol khí hoặc phản ứng không có chất khí sẽ có biến thiên entropy nhỏ (∆S ≈ 0)
a) Phản ứng làm tăng số mol khí ⇒ ∆S > 0
b) Phản ứng làm giảm số mol khí ⇒ ∆S < 0
c) Phản ứng có số mol khí trước và sau phản ứng bằng nhau ⇒ ∆S ≈ 0
d) Phản ứng có số mol khí trước và sau phản ứng bằng nhau ⇒ ∆S ≈ 0
e) Phản ứng làm tăng số mol khí ⇒ ∆S > 0