Sử dụng thể Open – local của phần mềm Yenka, thực hiện thí nghiệm ảnh hưởng của nhiệt độ
Giải Chuyên đề Hóa học 10 Bài 9: Thực hành thí nghiệm hóa học ảo
Haylamdo biên soạn và sưu tầm lời giải Bài 2 trang 62 Chuyên đề Hóa học 10 trong Bài 9: Thực hành thí nghiệm hóa học ảo sách Chân trời sáng tạo. Với lời giải hay và chi tiết hy vọng sẽ giúp các học sinh dễ dàng nắm được cách làm bài tập trong Chuyên đề Hóa 10.
Bài 2 trang 62 Chuyên đề Hóa học 10: Sử dụng thể Open – local của phần mềm Yenka, thực hiện thí nghiệm ảnh hưởng của nhiệt độ lên tốc độ phản ứng “Temperature and rate”. Phân tích và lí giải kết quả của thí nghiệm.
Lời giải:
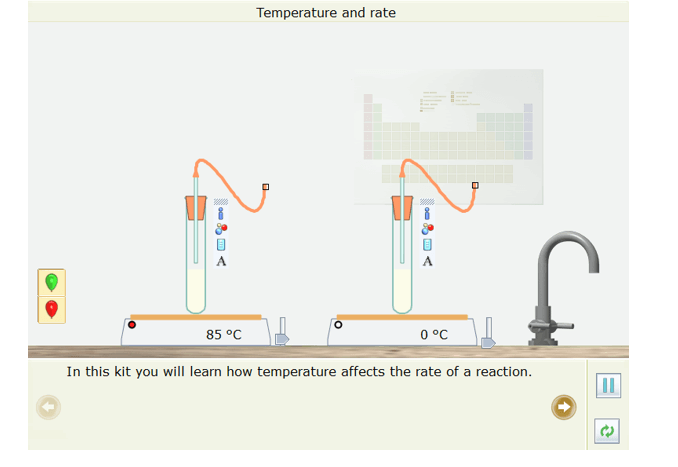
Bước 1: Nhấp chuột vào thể Open – local, chọn Reaction → Temperature and rate. Mô phỏng đã được thiết kế xuất hiện ở màn hình
Bước 2: Nhấp chuột vào Next page 
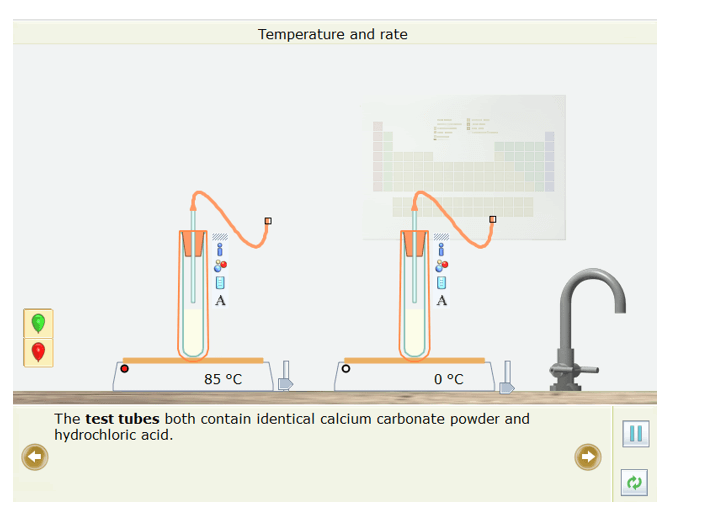
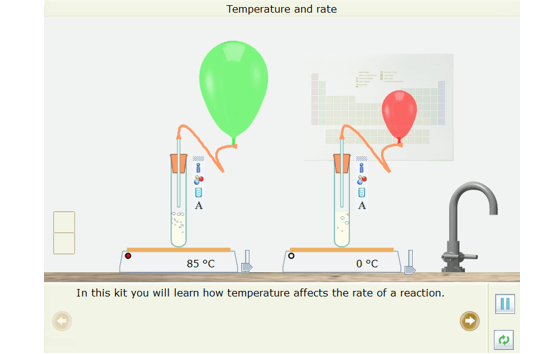
- Cả hai ống nghiệm đều chứa bột calcium carbonate và hydrochloric giống hệt nhau
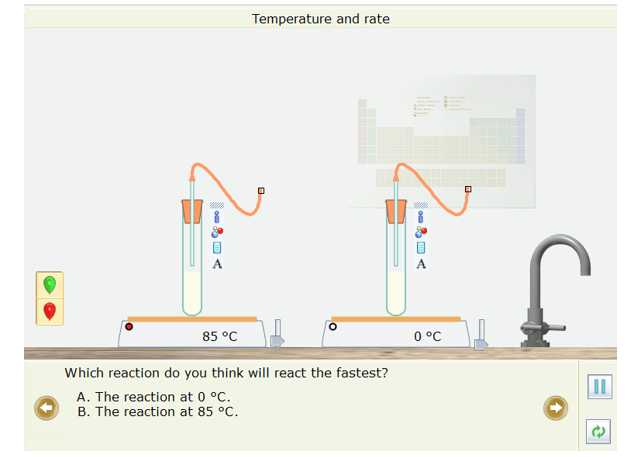
- Em hãy dự đoán xem phản ứng ở ống nghiệm nào nhanh nhất?
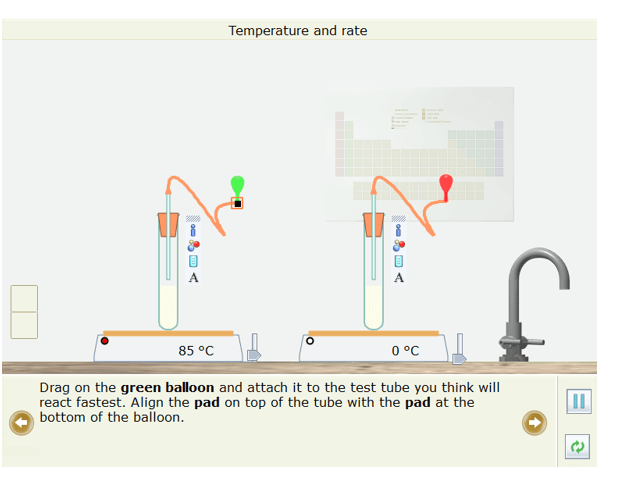
- Kéo quả bóng bay màu xanh lá cây lên và gắn nó vào ống nghiệm em cho là sẽ phản ứng nhanh nhất. Căn chỉnh miếng đệm trên đầu ống với miếng đệm ở đáy của quả bóng bay. Tương tự gắn quả bóng màu đỏ vào ống nghiệm mà em cho rằng sẽ phản ứng chậm nhất.
- Nhấp chuột vào nút Play/Pause 
Bước 3: Ghi lại kết quả thí nghiệm và nhận xét
- Kết quả: Quả bóng ở ống nghiệm được đun nóng đến 85oC to lên nhanh hơn và vỡ trước.
- Nhận xét: Phương trình hóa học của phản ứng:
CaCO3(s) + 2HCl(aq) → CaCl2(aq) + CO2(g) + H2O(l)
Quả bóng ở ống nghiệm được đun nóng đến 85oC to lên nhanh hơn. Chứng tỏ nhiệt độ càng cao thì tốc độ phản ứng càng lớn.