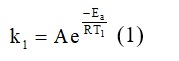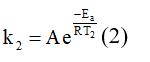Một phản ứng có năng lượng hoạt hóa là 24 kJ/mol, so sánh tốc độ phản ứng
Giải Chuyên đề Hóa học 10 Bài 3: Năng lượng hoạt hóa của phản ứng hóa học
Haylamdo biên soạn và sưu tầm lời giải Luyện tập 1 trang 25 Chuyên đề Hóa học 10 trong Bài 3: Năng lượng hoạt hóa của phản ứng hóa học sách Chân trời sáng tạo. Với lời giải hay và chi tiết hy vọng sẽ giúp các học sinh dễ dàng nắm được cách làm bài tập trong Chuyên đề Hóa 10.
Luyện tập 1 trang 25 Chuyên đề Hóa học 10: Một phản ứng có năng lượng hoạt hóa là 24 kJ/mol, so sánh tốc độ phản ứng ở 2 nhiệt độ là 27oC và 127oC.
Lời giải:
Dựa vào phương trình Arrhenius, tốc độ phản ứng tại thời điểm T1 là:
Tốc độ phản ứng tại thời điểm T2 là:
Chia hai vế phương trình (2) cho (1), thu được:
Vậy khi tăng nhiệt độ từ 27oC lên 127oC thì tốc độ phản ứng tăng 11,08 lần.