ion Na+ và Cl- trong nước có thể tính theo công thức
Bài 14: Dòng điện trong chất điện phân
Bài 10 (trang 85 SGK Vật Lý 11) ion Na+ và Cl- trong nước có thể tính theo công thức: v=μE trong đó E là cường độ điện trường, μ là độ linh động có giá trị lần lượt là 4,5.10-8 m2/ V.s. Tính điện trở suất của dung dịch NaCl nồng độ 0,1 mol/l, cho rằng toàn bộ các phần tử NaCl đều phân li thành icon.
Lời giải:
n1 là mật độ hạt tải điện ion Na+; n2 = mật độ hạt tải điện là ion Cl-.
σ là độ dẫn điện; ρ = 1/ σ là điện trở suất.
Vì Na+ nhẹ hơn Cl- nên có độ linh động μ+ > μ-;
μ+ = 6,8.10-8 m2/ V.s; μ- = 4,5.10-8 m2/ V.s
Khi phân li, số ion Na+ bằng số ion Cl-. Do đó, theo đề:
n0 là nồng độ của dung dịch NaCl:
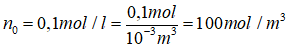
→ n1 = n2 = n = n0.NA = 100.6,02.1023 = 6,02.1025 hạt/m3

