Hòa tan hoàn toàn 0,8 g một kim loại hoá trị II hoà tan hoàn toàn trong 100 ml H2SO4 0,5 M
Bài 4: Phản ứng trao đổi ion trong dung dịch các chất điện li
Giải bài 10 trang 7 SBT Hóa 11 Bài 4: Phản ứng trao đổi ion trong dung dịch các chất điện li giúp học sinh biết cách làm bài tập trong SBT Hóa 11.
Bài 4.10 trang 7 Sách bài tập Hóa học 11: Hòa tan hoàn toàn 0,8 g một kim loại hoá trị II hoà tan hoàn toàn trong 100 ml H2SO4 0,5 M. Lượng axit còn dư phản ứng vừa đủ với 33,4 ml dung dịch NaOH 1,00 M. Xác định tên kim loại.
Lời giải:
Số mol H2SO4 trong 100ml dung dịch 0,5M là :
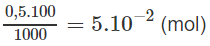
Số mol NaOH trong 33,4 ml nồng độ 1M :
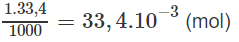
H2SO4 + 2NaOH → Na2SO4 + 2H2O
Lượng H2SO4 đã phản ứng với NaOH :
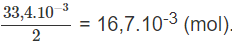
Số mol H2SO4 đã phản ứng với kim loại là :
5.10-2 - 1.67.10-2 = 3,33.10-2 mol
Dung dịch H2SO4 0,5M là dung dịch loãng nên :
X + H2SO4 → XSO4 + H2↑
Số mol X và số mol H2SO4 phản ứng bằng nhau, nên :
3,33.10-2 mol X có khối lượng 0,8 g
1 mol X có khối lượng:
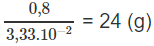
⇒ Mkim loại = 24 g/mol.
Vậy kim loại hoá trị II là magie.

