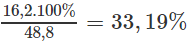Có một hỗn hợp ba muối NH4HCO3, NaHCO3, Ca(HCO3)2. Khi nung 48,8 g hỗn hợp đó đến khối lượng không đổi
Bài 16: Hợp chất của cacbon
Giải bài 6 trang 24 SBT Hóa 11 Bài 16: Hợp chất của cacbon giúp học sinh biết cách làm bài tập trong SBT Hóa 11.
Bài 16.6 trang 24 Sách bài tập Hóa học 11: Có một hỗn hợp ba muối NH4HCO3, NaHCO3, Ca(HCO3)2. Khi nung 48,8 g hỗn hợp đó đến khối lượng không đổi, thu được 16,2 g bã rắn. Chế hoá bã rắn với dung dịch HCl lấy dư, thu được 2,24 lít khí (đktc).
Xác định thành phần phần trăm của các muối trong hỗn hợp.
Lời giải:
Các phản ứng phân hủy muối khi nung :
NH4HCO3 to→ NH3 + CO2 + H2O (1)
2NaHCO3to→ Na2CO3 + CO2 + H2O
Ca(HCO3)2 to→ CaO + 2CO2 + H2O (3)
Bã rắn thu được sau khi nung gồm Na2CO3 và CaO, chúng tan trong dung dịch HCl dư theo các phương trình hoá học :
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O (4)
CaO + 2HCl → CaCl2 + H2O (5)
Theo (4):
nNa2CO3 = nCO2 = 0,1 (mol), hay 106 x 0,1 = 10,6 (g) Na2CO3
Theo (2):
nNaHCO3 = 2.nNa2CO3 = 2.0,1 = 0,2 (mol), hay 84.0,2 = 16,8 (g) NaHCO3.
Số mol CaO có trong bã rắn:
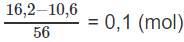
Theo (3):
nCa(HCO3)2 = nCaO = 0.1 (mol), hay 162 x 0,1 = 16,2 (g) Ca(HCO3)2.
Khối lượng NH4HCO3 có trong hỗn hợp: 48,8 - (16,8 + 16,2) = 15,8 (g).
Thành phần phần trăm của hỗn hợp muối:
%mNH4HCO3 =
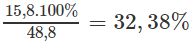
%mNaHCO3 =
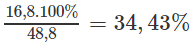
%mCa(HCO3)2 =