Đốt cháy a gam photpho đỏ trong không khí lấy dư, rồi cho sản phẩm thu được vào 500,0 ml dung dịch H3PO4 85,00% (D = 1,7 g/ml)
Bài 10: Photpho
Giải bài 7 trang 17 SBT Hóa 11 Bài 10: Photpho giúp học sinh biết cách làm bài tập trong SBT Hóa 11.
Bài 10.7 trang 17 Sách bài tập Hóa học 11: Đốt cháy a gam photpho đỏ trong không khí lấy dư, rồi cho sản phẩm thu được vào 500,0 ml dung dịch H3PO4 85,00% (D = 1,7 g/ml). Sau khi phản ứng xảy ra hoàn toàn nồng độ của dung dịch H3PO4 xác định được là 92,60%. Tính giá trị của a.
Lời giải:
Photpho cháy trong không khí lấy dư theo phản ứng :
4P + 5O2 to→ 2P2O5 (1)
4 mol (4 x 31,0 g) 2 mol (2 x 1420,0 g)
P2O5 tác dụng với tạo thành H3PO4 theo phản ứng :
P2O5 + 3H2O → 2H3PO4 (2)
1 mol (142,0 g) 2 mol (2 x 98,0 g)
Theo phản ứng (1): 4 x 31,0 g P tạo ra 2 x 142,0 g P2O5
a g P tạo ra
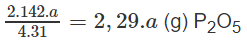
Theo các phản ứng (1) và (2) :
4 x 31,0 (g) P tạo ra 4 x 98,0 (g) H3PO4
a (g) P tạo ra
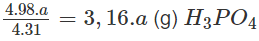
Khối lượng H3PO4 có trong 500,0 ml dung dịch 85,00% :
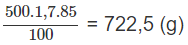
Khối lượng H3PO4 sau khi đã hoà tan P2O5: 722,5 g + 3,16 x a g.
Khối lượng của dung dịch H3PO4 sau khi đã hoà tan P2O5:
500,0 x 1,7 g + 2,29 x a g = 850,0 g + 2,29 x a g
Ta có phương trình về nồng độ phần trăm của dung dịch H3PO4:
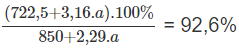
Giải phương trình được a = 62,16 g photpho.

