Giáo án Hóa 11 Kết nối tri thức (năm 2023 mới nhất) | Giáo án Hóa học 11
Haylamdo biên soạn và sưu tầm Tài liệu Giáo án Hóa 11 Kết nối tri thức đầy đủ, chuẩn nhất theo Bộ GD giúp thầy cô dễ dàng soạn giáo án môn Hóa học 11 cho học sinh của mình theo chương trình mới.
Giáo án Hóa 11 Kết nối tri thức (năm 2023 mới nhất)
Để mua trọn bộ Hóa 11 Kết nối tri thức mới, chuẩn nhất, đẹp mắt, quý Thầy/Cô vui lòng truy cập tailieugiaovien.com.vn
BÀI 1: KHÁI NIỆM VỀ CÂN BẰNG HOÁ HỌC
I. Mục tiêu
1) Kiến thức
- Trình bày được khái niệm phản ứng thuận nghịch và trạng thái cân bằng của phản ứng thuận nghịch.
- Viết được hằng số cân bằng (KC) của phản ứng thuận nghịch.
- Thực hiện thí nghiệm nghiên cứu ảnh hưởng của nhiệt độ tới chuyển dịch cân bằng:
(1) Phản ứng: 2NO2 ⇌ N2O4
(2) Phản ứng thuỷ phân sodium acetate.
- Vận dụng được nguyên lí chuyển dịch cân bằng Le Chatelier để giải thích ảnh hưởng của nhiệt độ, nồng độ, áp suất đến cân bằng hoá học.
2) Năng lực
a) Năng lực chung
- Năng lực tự chủ và tự học: Kĩ năng tìm kiếm thông tin để xác định phản ứng toả nhiệt hay thu nhiệt, cân bằng hoá học, các yếu tố ảnh hưởng đến cân bằng hoá học.
- Năng lực giao tiếp: Tiếp thu kiến thức, trao đổi học hỏi bạn bè thông qua việc thực hiện nhiệm vụ các hoạt động cặp đôi, nhóm; có thái độ tôn trọng, lắng nghe, có phản ứng tích cực trong giao tiếp.
- Năng lực hợp tác: Làm việc nhóm trong thực hành thí nghiệm và hoàn thiện các phiếu học tập.
- Năng lực giải quyết vấn đề và sáng tạo: Vận dụng được nguyên lí chuyển dịch cân bằng Le Chatelier để giải thích ảnh hưởng của nhiệt độ, nồng độ, áp suất đến cân bằng hoá học.
b) Năng lực chuyên biệt
- Năng lực nhận thức hóa học: Trình bày được khái niệm phản ứng thuận nghịch và trạng thái cân bằng của phản ứng thuận nghịch; Viết được hằng số cân bằng (KC) của phản ứng thuận nghịch.
- Năng lực tìm hiểu thế giới tự nhiên dưới góc độ hóa học: Giải thích được các cân bằng hoá học diễn ra trong tự nhiên và trong cơ thể con người. Áp dụng trong việc chăm sóc sức khoẻ và giải thích các hiện tượng tự nhiên.
- Năng lực vận dụng kiến thức, kỹ năng đã học: Vận dụng được nguyên lí chuyển dịch cân bằng Le Chatelier để giải thích ảnh hưởng của nhiệt độ, nồng độ, áp suất đến cân bằng hoá học.
3) Phẩm chất
- Trách nhiệm: nghiêm túc thực hiện các nhiệm vụ học tập được giao.
- Trung thực: thành thật trong việc thu thập các tài liệu, viết báo cáo và các bài tập.
- Chăm chỉ: tích cực trong các hoạt động cá nhân, tập thể.
- Nhân ái: quan tâm, giúp đỡ, chia sẻ những khó khăn trong việc thực hiện nhiệm vụ học tập.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
1. Giáo viên
- Video minh hoạ thí nghiệm 1; thí nghiệm 2 trong SGK.
- 6 bộ hoá chất dụng cụ:
+ Hoá chất: tinh thể CH3COONa; dung dịch CH3COOH; H2O; phenolphthalein.
+ Dụng cụ: ống nghiệm, ống hút nhỏ giọt, giá để ống nghiệm.
- Thiết kế các phiếu học tập, slide…
- Máy tính, máy chiếu …
2. Học sinh
- SGK, vở ghi…
III. TIẾN TRÌNH DẠY HỌC
A. HOẠT ĐỘNG KHỞI ĐỘNG
Hoạt động 1: Mở đầu
a. Mục tiêu: Tạo tâm thế hứng thú cho học sinh và từng bước làm quen bài mới.
b. Nội dung:
HS làm việc theo cặp đôi, trả lời câu hỏi mở đầu từ đó hình thành nên mục tiêu bài học.
|
CÂU HỎI MỞ ĐẦU Phản ứng hoá học là quá trình biến đổi các chất đầu thành sản phẩm. Tuy nhiên, có nhiều phản ứng, các chất sản phẩm sinh ra lại có thể phản ứng được với nhau tạo thành chất đầu. Đối với những phản ứng này, làm thế nào để thu được nhiều sản phẩm hơn và làm tăng hiệu suất phản ứng? |
c. Sản phẩm:
Câu trả lời của HS, dự kiến:
Đối với các phản ứng này, người ta thường vận dụng nguyên lí chuyển dịch cân bằng Le Chatelier để chuyển dịch cân bằng theo mong muốn nhằm thu được nhiều sản phẩm hơn và làm tăng hiệu suất phản ứng.
d. Tổ chức thực hiện:
Bước 1. Chuyển giao nhiệm vụ học tập
- GV yêu cầu HS làm việc theo cặp đôi, trả lời câu hỏi mở đầu.
- HS nhận nhiệm vụ.
Bước 2. Thực hiện nhiệm vụ học tập
- HS làm việc theo cặp đôi, trả lời câu hỏi.
- GV theo dõi, đôn đốc HS.
Bước 3. Báo cáo kết quả hoạt động
- Đại diện 1 HS trình bày câu trả lời; Các HS còn lại chú ý lắng nghe, góp ý (nếu có).
Bước 4. Đánh giá kết quả thực hiện nhiệm vụ
- Câu trả lời của HS có thể đúng hoặc sai, GV không nhận xét tính đúng/ sai mà dựa vào đó để dẫn dắt vào bài mới.
GV dẫn dắt vào bài: Để nhận xét câu trả lởi của bạn đã đầy đủ và chính xác chưa, sau đây cô cùng các em tìm hiểu bài 1: Khái niệm về cân bằng hoá học.
B. HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC MỚI
Hoạt động 2: Tìm hiểu về phản ứng một chiều và phản ứng thuận nghịch
a) Mục tiêu:
Trình bày được khái niệm phản ứng thuận nghịch.
b) Nội dung:
Học sinh làm việc theo nhóm, nghiên cứu SGK, hoàn thành phiếu học tập số 1, từ đó lĩnh hội kiến thức.
|
PHIẾU HỌC TẬP SỐ 1 Câu 1: Hãy chỉ ra phản ứng thuận nghịch trong hai phản ứng sau và nêu khái niệm phản ứng thuận nghịch. (1) KOH(aq) + HCl(aq) → KCl(aq) + H2O(l) (2) H2(g) + I2(g) ⇌ 2HI(g) Câu 2: Giải thích vì sao trong phản ứng thuận nghịch, dù thời gian phản ứng kéo dài bao lâu thì các chất đầu đều còn lại sau phản ứng? Câu 3: Phản ứng xảy ra khi cho khí Cl2 tác dụng với nước là phản ứng thuận nghịch. Viết phương trình hoá học của phản ứng, xác định phản ứng thuận, phản ứng nghịch. |
c) Sản phẩm:
Câu trả lời của HS, dự kiến:
Câu 1: Phản ứng thuận nghịch: H2(g) + I2(g) ⇌ 2HI(g)
Khái niệm: Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều ngược nhau trong cùng một điều kiện.
Câu 2: Do đối với phản ứng thuận nghịch, trong cùng một điều kiện, các chất phản ứng tác dụng với nhau tạo thành các chất sản phẩm (phản ứng thuận), đồng thời các chất sản phẩm lại tác dụng với nhau tạo thành các chất ban đầu (phản ứng nghịch).
Câu 3: Phương trình hoá học của phản ứng xảy ra khi cho khí Cl2 tác dụng với nước:
Cl2(aq) + H2O(l) ⇌ HCl(aq) + HClO(aq)
Phản ứng thuận: Cl2 + H2O → HCl + HClO.
Phản ứng nghịch: HCl + HClO → Cl2 + H2O.
d) Tổ chức thực hiện:
|
HOẠT ĐỘNG CỦA GV VÀ HS |
NỘI DUNG |
|
Bước 1. Chuyển giao nhiệm vụ học tập - GV chia lớp thành 6 nhóm, các nhóm nghiên cứu SGK, thảo luận và hoàn thành phiếu học tập số 1 (10 phút). - HS nhận nhiệm vụ. Bước 2. Thực hiện nhiệm vụ học tập - HS làm việc theo nhóm. - GV theo dõi, đôn đốc và hỗ trợ HS khi cần thiết. Bước 3. Báo cáo kết quả hoạt động và thảo luận - 3 HS đại diện 3 nhóm trình bày kết quả thảo luận (mỗi HS trình bày 1 câu). - Các HS còn lại chú ý theo dõi và nhận xét, góp ý (nếu có). Bước 4. Đánh giá kết quả thực hiện nhiệm vụ GV tổng kết, chuẩn hoá kiến thức. |
I. Phản ứng một chiều và phản ứng thuận nghịch 1. Phản ứng một chiều Trong cùng một điều kiện, các chất sản phẩm không phản ứng được với nhau để tạo thành chất đầu. Phản ứng này được gọi là phản ứng một chiều. Phương trình hoá học của phản ứng một chiều được biểu diễn bằng một mũi tên chỉ chiều phản ứng (→). 2. Phản ứng thuận nghịch Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều ngược nhau trong cùng một điều kiện. Phương trình hoá học của phản ứng thuận nghịch được biểu diễn bằng hai nửa mũi tên ngược chiều nhau. Chiều từ trái sang phải là chiều thuận, chiều từ phải sang trái là chiều nghịch. Trong thực tế, các phản ứng thuận nghịch xảy ra không hoàn toàn bởi vì trong cùng một điều kiện, các chất phản ứng tác dụng với nhau tạo thành các chất sản phẩm (phản ứng thuận), đồng thời các chất sản phẩm lại tác dụng với nhau tạo thành chất ban đầu (phản ứng nghịch). |
Hoạt động 3: Tìm hiểu về cân bằng hoá học
a) Mục tiêu:
- Trình bày được trạng thái cân bằng của phản ứng thuận nghịch.
- Viết được biểu thức hằng số cân bằng (KC) của phản ứng thuận nghịch.
b) Nội dung:
- HS làm việc theo nhóm, hoàn thành các phiếu học tập từ đó lĩnh hội kiến thức.
PHIẾU HỌC TẬP SỐ 2
Xét phản ứng thuận nghịch: H2(g) + I2(g) ⇌ 2HI(g).
Số liệu về sự thay đổi số mol các chất trong bình phản ứng ở thí nghiệm 1 được trình bày trong Bảng 1.1 dưới đây:
Bảng 1.1. Số mol các chất trong bình phản ứng của thí nghiệm 1 thay đổi theo thời gian
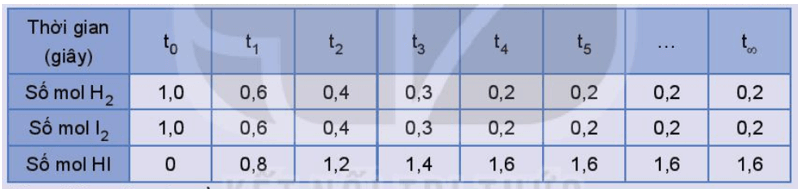
Thực hiện các yêu cầu:
1) Vẽ đồ thị biểu diễn sự thay đổi số mol các chất theo thời gian.
2) Từ đồ thị, nhận xét về sự thay đổi số mol của các chất theo thời gian.
3) Viết biểu thức định luật tác dụng khối lượng đối với phản ứng thuận và phản ứng nghịch, từ đó dự đoán sự thay đổi tốc độ của mỗi phản ứng theo thời gian (biết các phản ứng này đều là phản ứng đơn giản).
4) Bắt đầu từ thời điểm nào thì số mol các chất trong hệ phản ứng không thay đổi nữa?
5) Trạng thái cân bằng của phản ứng thuận nghịch là gì?
PHIẾU HỌC TẬP SỐ 3
Xét phản ứng thuận nghịch: H2(g) + I2(g) ⇌ 2HI(g)
Thực hiện phản ứng trên ở trong bình kín, ở nhiệt độ 445 oC với các nồng độ ban đầu khác nhau. Số liệu về nồng độ các chất ở thời điểm ban đầu và trạng thái cân bằng trong các thí nghiệm được trình bày trong Bảng 1.2.
Bảng 1.2. Nồng độ các chất của phản ứng H2(g) + I2(g) ⇌ 2HI(g) ở thời điểm ban đầu và ở trạng thái cân bằng.
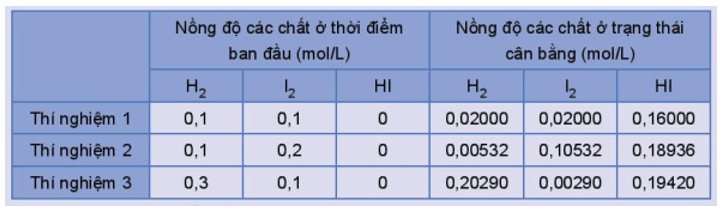
Trả lời các câu hỏi sau:
1) Tính giá trị ở mỗi thí nghiệm, nhận xét kết quả thu được.
2) Xét phản ứng thuận nghịch tổng quát: aA + bB ⇌ cC + dD
Xác định biểu thức tính hằng số cân bằng (KC) của phản ứng ở trạng thái cân bằng.
3) Hằng số cân bằng của phản ứng phụ thuộc vào các yếu tố nào? Nêu ý nghĩa của hằng số cân bằng.
c) Sản phẩm:
- Câu trả lời của HS. Dự kiến:
PHIẾU HỌC TẬP SỐ 2
1)
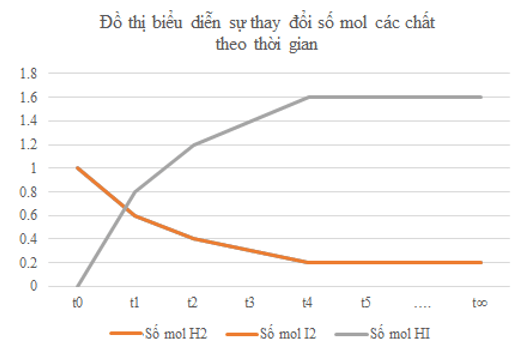
2) Từ đồ thị ta thấy: Lúc đầu số mol sản phẩm chưa có, theo thời gian, số mol chất tham gia (hydrogen, iodine) giảm dần, số mol chất sản phẩm (hydrogen iodide) tăng dần, đến khi số mol của các chất hydrogen, iodine, hydrogen iodide không thay đổi nữa.
3) Biểu thức định luật tác dụng khối lượng:
- Đối với phản ứng thuận: vthuận =
- Đối với phản ứng nghịch: vnghịch =
Dự đoán:
- Ban đầu tốc độ phản ứng thuận giảm dần, sau một thời gian tốc độ phản ứng thuận không thay đổi theo thời gian.
- Ban đầu tốc độ phản ứng nghịch tăng dần, sau một thời gian tốc độ phản ứng nghịch không thay đổi theo thời gian.
4) Tại thời điểm phản ứng thuận nghịch đạt tới trạng thái cân bằng thì số mol các chất trong hệ phản ứng không thay đổi nữa.
5) Trạng thái cân bằng của phản ứng thuận nghịch là trạng thái tại đó tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
PHIẾU HỌC TẬP SỐ 3
1) Giá trị hằng số cân bằng ở mỗi thí nghiệm:
- Thí nghiệm 1:
- Thí nghiệm 2:
- Thí nghiệm 3:
Nhận xét: Hằng số cân bằng KC ở 3 thí nghiệm là tương tự nhau.
2) Xét phản ứng thuận nghịch tổng quát: aA + bB ⇌ cC + dD
Ở trạng thái cân bằng, hằng số cân bằng (KC) của phản ứng được xác định bằng biểu thức:
KC =
Trong đó: [A]; [B]; [C]; [D] là nồng độ mol của các chất A, B, C, D ở trạng thái cân bằng; a, b, c, d là hệ số tỉ lượng của các chất trong phương trình hoá học của phản ứng.
3) Hằng số cân bằng KC của một phản ứng thuận nghịch chỉ phụ thuộc vào nhiệt độ và bản chất của phản ứng.
Biểu thức xác định hằng số cân bằng KC = cho thấy; KC càng lớn thì phản ứng thuận càng chiếm ưu thế hơn và ngược lại; KC càng nhỏ thì phản ứng nghịch càng chiếm ưu thế hơn.
d) Tổ chức thực hiện:
|
HOẠT ĐỘNG CỦA GV VÀ HS |
NỘI DUNG |
|
Nhiệm vụ 1: Tìm hiểu trạng thái cân bằng Bước 1. Chuyển giao nhiệm vụ học tập - GV chia lớp thành 6 nhóm, các nhóm nghiên cứu SGK, thảo luận và hoàn thành phiếu học tập số 2 (12 phút). - HS nhận nhiệm vụ. Bước 2. Thực hiện nhiệm vụ học tập - HS làm việc theo nhóm. - GV theo dõi, đôn đốc và hỗ trợ HS khi cần thiết. Bước 3. Báo cáo kết quả hoạt động và thảo luận - 2 HS đại diện 2 nhóm trình bày kết quả thảo luận của nhóm. - Các HS còn lại chú ý theo dõi và nhận xét, góp ý (nếu có). Bước 4. Đánh giá kết quả thực hiện nhiệm vụ GV tổng kết, chuẩn hoá kiến thức và nhấn mạnh cân bằng hoá học là một cân bằng động. Nhiệm vụ 2: Tìm hiểu hằng số cân bằng, ý nghĩa của hằng số cân bằng Bước 1. Chuyển giao nhiệm vụ học tập - GV chia lớp thành 6 nhóm, các nhóm nghiên cứu SGK, thảo luận và hoàn thành phiếu học tập số 3 (6 phút). - HS nhận nhiệm vụ. Bước 2. Thực hiện nhiệm vụ học tập - HS làm việc theo nhóm. - GV theo dõi, đôn đốc và hỗ trợ HS khi cần thiết. Bước 3. Báo cáo kết quả hoạt động và thảo luận - 2 HS đại diện 2 nhóm trình bày kết quả thảo luận của nhóm. - Các HS còn lại chú ý theo dõi và nhận xét, góp ý (nếu có). Bước 4. Đánh giá kết quả thực hiện nhiệm vụ GV tổng kết, chuẩn hoá kiến thức và nhấn mạnh: Đối với các phản ứng có chất rắn tham gia, không biểu diễn nồng độ của chất rắn trong biểu thức hằng số cân bằng.
|
II. Cân bằng hoá học 1. Trạng thái cân bằng - Trạng thái cân bằng của phản ứng thuận nghịch là trạng thái tại đó tốc độ phản ứng thuận bằng với tốc độ phản ứng nghịch. - Cân bằng hoá học là một cân bằng động, các chất tham gia phản ứng liên tục phản ứng với nhau để tạo thành sản phẩm và các sản phẩm cũng liên tục phản ứng với nhau để tạo thành chất đầu nhưng với tốc độ bằng nhau nên ở trạng thái cân bằng, nồng độ các chất không thay đổi.
II. Hằng số cân bằng a) Biểu thức hằng số cân bằng Xét phản ứng thuận nghịch tổng quát: aA + bB ⇌ cC + dD Ở trạng thái cân bằng, hằng số cân bằng (KC) của phản ứng được xác định bằng biểu thức: KC = Trong đó: [A]; [B]; [C]; [D] là nồng độ mol của các chất A, B, C, D ở trạng thái cân bằng; a, b, c, d là hệ số tỉ lượng của các chất trong phương trình hoá học của phản ứng. Hằng số cân bằng KC của một phản ứng thuận nghịch chỉ phụ thuộc vào nhiệt độ và bản chất của phản ứng. Đối với các phản ứng có chất rắn tham gia, không biểu diễn nồng độ của chất rắn trong biểu thức hằng số cân bằng. b) Ý nghĩa của hằng số cân bằng Biểu thức xác định hằng số cân bằng KC = cho thấy; KC càng lớn thì phản ứng thuận càng chiếm ưu thế hơn và ngược lại; KC càng nhỏ thì phản ứng nghịch càng chiếm ưu thế hơn. |
Hoạt động 4: Tìm hiểu ảnh hưởng của nhiệt độ đến sự chuyển dịch cân bằng hoá học
a) Mục tiêu:
- Quan sát thí nghiệm giải thích được ảnh hưởng của nhiệt độ tới chuyển dịch cân bằng:
(1) Phản ứng: 2NO2 ⇌ N2O4
(2) Phản ứng thuỷ phân sodium acetate.
b) Nội dung:
- HS quan sát video thí nghiệm 1, thí nghiệm 2 thảo luận theo nhóm nhỏ, hoàn thành phiếu học tập từ đó rút ra ảnh hưởng của nhiệt độ tới tốc độ phản ứng.
PHIẾU HỌC TẬP SỐ 4
Câu 1: Quan sát sự đổi màu sắc của khí trong các ống nghiệm ở video thí nghiệm 1: Ảnh hưởng của nhiệt độ đến sự chuyển dịch cân bằng:
2NO2(g) ⇌ N2O4(g)
(màu nâu đỏ) (không màu)
Hoàn thành bảng sau:
|
Tác động |
Hiện tượng |
Chiều chuyển dịch cân bằng (thuận/ nghịch) |
Chiều chuyển dịch cân bằng (toả nhiệt/ thu nhiệt) |
|
Tăng nhiệt độ |
? |
? |
? |
|
Giảm nhiệt độ |
? |
? |
? |
Câu 2: Quan sát sự đổi màu sắc của dung dịch trong các ống nghiệm ở video thí nghiệm 2: Ảnh hưởng của nhiệt độ đến sự chuyển dịch cân bằng:
CH3COONa + H2O ⇌ CH3COOH + NaOH
Hoàn thành bảng sau:
|
Tác động |
Hiện tượng |
Chiều chuyển dịch cân bằng (thuận/ nghịch) |
Chiều chuyển dịch cân bằng (phản ứng toả nhiệt/ phản ứng thu nhiệt) |
|
Tăng nhiệt độ |
? |
? |
? |
|
Giảm nhiệt độ |
? |
? |
? |
Câu 3: Khi tăng nhiệt độ cân bằng chuyển dịch theo chiều nào?
c) Sản phẩm:
Câu trả lời của học sinh. Dự kiến:
Câu 1:
|
Tác động |
Hiện tượng |
Chiều chuyển dịch cân bằng (thuận/ nghịch) |
Chiều chuyển dịch cân bằng (toả nhiệt/ thu nhiệt) |
|
Tăng nhiệt độ |
Màu khí trong ống nghiệm đậm dần lên |
Nghịch |
Thu nhiệt |
|
Giảm nhiệt độ |
Màu khí trong ống nghiệm nhạt dần đi |
Thuận |
Toả nhiệt |
Câu 2:
|
Tác động |
Hiện tượng |
Chiều chuyển dịch cân bằng (thuận/ nghịch) |
Chiều chuyển dịch cân bằng (phản ứng toả nhiệt/ phản ứng thu nhiệt) |
|
Tăng nhiệt độ |
Dung dịch trong ống nghiệm đậm màu hơn |
Thuận |
Phản ứng thu nhiệt |
|
Giảm nhiệt độ |
Dung dịch trong ống nghiệm nhạt màu hơn |
Nghịch |
Phản ứng toả nhiệt |
Câu 3: Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều làm giảm nhiệt độ, tức là chiều phản ứng thu nhiệt, nghĩa là chiều làm giảm tác động của việc tăng nhiệt độ và ngược lại.
d) Tổ chức thực hiện:
|
HOẠT ĐỘNG CỦA GV VÀ HS |
NỘI DUNG |
|
Bước 1. Chuyển giao nhiệm vụ học tập - GV chia lớp thành 6 nhóm, các nhóm xem video thí nghiệm, thảo luận và hoàn thành phiếu học tập số 4 (6 phút). - HS nhận nhiệm vụ. Bước 2. Thực hiện nhiệm vụ học tập - HS làm việc theo nhóm. - GV theo dõi, đôn đốc và hỗ trợ HS khi cần thiết. Bước 3. Báo cáo kết quả hoạt động và thảo luận - 2 HS đại diện 2 nhóm trình bày kết quả thảo luận của nhóm. - Các HS còn lại chú ý theo dõi và nhận xét, góp ý (nếu có). Bước 4. Đánh giá kết quả thực hiện nhiệm vụ GV tổng kết, chuẩn hoá kiến thức và nhấn mạnh ảnh hưởng của nhiệt độ tới tốc độ phản ứng. |
III. Các yếu tố ảnh hưởng đến chuyển dịch cân bằng hoá học 1. Ảnh hưởng của nhiệt độ Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều làm giảm nhiệt độ, tức là chiều phản ứng thu nhiệt, nghĩa là chiều làm giảm tác động của việc tăng nhiệt độ và ngược lại.
|
Hoạt động 5: Tìm hiểu ảnh hưởng của nồng độ đến cân bằng hoá học
a) Mục tiêu:
- Nêu được ảnh hưởng của nồng độ đến cân bằng hoá học.
b) Nội dung:
- HS làm việc theo nhóm, thực hành thí nghiệm và hoàn thành phiếu học tập từ đó lĩnh hội kiến thức.
|
PHIẾU HỌC TẬP SỐ 5 Thực hiện thí nghiệm sau và trả lời câu hỏi bên dưới: Thí nghiệm: Nghiên cứu ảnh hưởng của nồng độ đến sự chuyển dịch cân bằng: CH3COONa + H2O ⇌ CH3COOH + NaOH Cách tiến hành: - Cho một vài giọt phenolphthalein vào dung dịch CH3COONa, lắc đều, dung dịch có màu hồng nhạt. - Chia dung dịch thu được vào 3 ống nghiệm với thể tích gần bằng nhau. Ống nghiệm (1) để so sánh, ống nghiệm (2) thêm vài tinh thể CH3COONa, ống nghiệm (3) thêm một vài giọt dung dịch CH3COOH. Câu 1: Quan sát sự thay đổi màu sắc của dung dịch trong các ống nghiệm và hoàn thành vào vở theo mẫu bảng sau: 
Câu 2: Khi tăng nồng độ của một chất trong phản ứng thì cân bằng chuyển dịch theo chiều nào? |
c) Sản phẩm:
Câu trả lời của HS, dự kiến:
Câu 1:
|
Tác động |
Hiện tượng |
Chiều chuyển dịch cân bằng (thuận/ nghịch) |
Chiều chuyển dịch cân bằng (tăng/ giảm nồng độ) |
|
Tăng nồng độ CH3COONa |
Dung dịch trong ống nghiệm đậm màu hơn |
Thuận |
Giảm nồng độ CH3COONa |
|
Tăng nồng độ CH3COOH |
Dung dịch trong ống nghiệm nhạt màu hơn |
Nghịch |
Giảm nồng độ CH3COOH |
Câu 2: Khi tăng nồng độ của một chất trong phản ứng thì cân bằng hoá học bị phá vỡ và chuyển dịch theo chiều làm giảm nồng độ của chất đó và ngược lại.
d) Tổ chức thực hiện:
|
HOẠT ĐỘNG CỦA GV VÀ HS |
NỘI DUNG |
|
Bước 1. Chuyển giao nhiệm vụ học tập - GV chia lớp thành 6 nhóm, nhắc các quy tắc an toàn khi làm thí nghiệm. Sau đó yêu cầu các nhóm thực hiện nhiệm vụ trong phiếu học tập số 5. - HS nhận nhiệm vụ. Bước 2. Thực hiện nhiệm vụ học tập - HS làm việc theo nhóm. - GV theo dõi, đôn đốc và hỗ trợ HS khi cần thiết. Bước 3. Báo cáo kết quả hoạt động và thảo luận - 2 HS đại diện 2 nhóm trình bày kết quả thảo luận của nhóm. - Các HS còn lại chú ý theo dõi và nhận xét, góp ý (nếu có). Bước 4. Đánh giá kết quả thực hiện nhiệm vụ GV tổng kết, chuẩn hoá kiến thức và nhấn mạnh ảnh hưởng của nồng độ tới tốc độ phản ứng. |
2. Ảnh hưởng của nồng độ tới tốc độ phản ứng Khi tăng nồng độ của một chất trong phản ứng thì cân bằng hoá học bị phá vỡ và chuyển dịch theo chiều làm giảm nồng độ của chất đó và ngược lại.
|
Hoạt động 6: Tìm hiểu nguyên lí chuyển dịch cân bằng Le Chatelier
a) Mục tiêu:
- Vận dụng được nguyên lí chuyển dịch cân bằng Le Chatelier để giải thích ảnh hưởng của nhiệt độ, nồng độ, áp suất đến cân bằng hoá học.
b) Nội dung:
- HS làm việc theo cặp đôi, nêu nguyên lí chuyển dịch cân bằng Le Chatelier, từ đó vận dụng hoàn thiện câu 11 – SGK hoá học 11 trang 14.
|
Trong công nghiệp, khí hydrogen được điều chế như sau: Cho hơi nước đi qua than nung nóng, thu được hỗn hợp khí CO và H2 (gọi là khí than ướt): C(s) + H2O(g) ⇌ CO(g) + H2(g) Trộn khí than ướt với hơi nước, cho hỗn hợp đi qua chất xúc tác Fe2O3: CO(g) + H2O(g) ⇌ CO2(g) + H2(g) a) Vận dụng nguyên lí Le Chatelier, hãy cho biết cần tác động yếu tố nhiệt độ như thế nào để các cân bằng (1), (2) chuyển dịch theo chiều thuận. b) Trong thực tế, ở phản ứng (2), lượng hơi nước được lấy dư nhiều (4 – 5 lần) so với khí carbon monoxide. Giải thích. c) Nếu tăng áp suất, cân bằng (1), (2) chuyển dịch theo chiều nào? Giải thích. |
c) Sản phẩm:
Câu trả lời của HS, dự kiến:
Câu 11 – SGK Hoá học 11
a)
Cân bằng 1: C(s) + H2O(g) ⇌ CO(g) + H2(g)
Þ Chiều thuận thu nhiệt.
Vậy để cân bằng (1) chuyển dịch theo chiều thuận cần tăng nhiệt độ của hệ.
Cân bằng 2: CO(g) + H2O(g) ⇌ CO2(g) + H2(g)
Þ Chiều thuận toả nhiệt
Vậy để cân bằng (2) chuyển dịch theo chiều thuận cần giảm nhiệt độ của hệ.
b) Trong thực tế, ở phản ứng (2), lượng hơi nước được lấy dư nhiều (4 – 5 lần) so với khí carbon monoxide. Do:
+ Tăng lượng hơi nước Þ cân bằng chuyển dịch theo chiều thuận (tức chiều làm giảm lượng hơi nước) Þ tăng hiệu suất thu khí hydrogen.
+ Ngoài ra, hơi nước có giá thành rẻ hơn và không độc hại so với sử dụng lượng dư carbon monoxide.
c) Tăng áp suất, cân bằng (1) chuyển dịch theo chiều nghịch, cân bằng (2) không bị chuyển dịch.
d) Tổ chức thực hiện:
|
HOẠT ĐỘNG CỦA GV VÀ HS |
NỘI DUNG |
|
Bước 1. Chuyển giao nhiệm vụ học tập - GV yêu cầu 1 học sinh nêu nguyên lí chuyển dịch cân bằng Le Chatelier. Sau đó yêu cầu HS nghiên cứu ví dụ SGK, thảo luận theo cặp đôi hoàn thành câu hỏi 11 – SGK Hoá học 11 trang 14. - HS nhận nhiệm vụ. Bước 2. Thực hiện nhiệm vụ học tập - HS thảo luận cặp đôi hoàn thành câu hỏi 11. - GV theo dõi, đôn đốc và hỗ trợ HS. Bước 3. Báo cáo kết quả hoạt động và thảo luận - Đại diện HS trình bày kết quả thảo luận. - Các HS còn lại chú ý lắng nghe, góp ý nếu có. Bước 4. Đánh giá kết quả thực hiện nhiệm vụ GV tổng kết, chuẩn hoá kiến thức. |
3. Nguyên lí chuyển dịch cân bằng Le Chatelier Một phản ứng thuận nghịch đang ở trạng thái cân bằng, khi chịu một tác động bên ngoài làm thay đổi nồng độ, nhiệt độ, áp suất thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó. Nguyên lí chuyển dịch cân bằng Le Chatelier có ý nghĩa rất lớn khi được vận dụng vào kĩ thuật công nghiệp hoá học. Người ta có thể thay đổi các điều kiện để chuyển dịch cân bằng theo mong muốn, làm tăng hiệu suất của phản ứng. |
C. HOẠT ĐỘNG LUYỆN TẬP
a) Mục tiêu:
- Hệ thống được một số kiến thức đã học.
b) Nội dung:
- HS làm việc cá nhân, hoàn thành các bài tập sau:
Câu hỏi 7 trang 10 SGK Hoá học 11:
Ammonia (NH3) được điều chế bằng phản ứng: N2(g) + 3H2(g) ⇌ 2NH3(g)
Ở toC, nồng độ các chất ở trạng thái cân bằng là:
[N2] = 0,45 M; [H2] = 0,14 M; [NH3] = 0,62 M.
Tính hằng số cân bằng KC của phản ứng trên tại t oC.
Câu hỏi 8 trang 13 SGK Hoá học 11: Cho các cân bằng sau:
CaCO3(s) ⇌ CaO(s) + CO2(g)
2SO2(g) + O2(g) ⇌ 2SO3(g)
Nếu tăng nhiệt độ, các cân bằng trên chuyển dịch theo chiều nào? Giải thích.
Câu hỏi 9 trang 13 SGK Hoá học 11: Ester là hợp chất hữu cơ dễ bay hơi, một số ester được dùng làm chất tạo mùi thơm cho các loại bánh, thực phẩm. Phản ứng điều chế ester là một phản ứng thuận nghịch:
CH3COOH(l) + C2H5OH(l) ⇌ CH3COOC2H5(l) + H2O(l)
Hãy cho biết cân bằng trên chuyển dịch theo chiều nào nếu
a) Tăng nồng độ của C2H5OH.
b) Giảm nồng độ của CH3COOC2H5.
Câu hỏi 10 trang 14 SGK Hoá học 11: Cho các cân bằng sau:
a) 2SO2(g) + O2(g) ⇌ 2SO3(g)
b) CO(g) + H2O(g) ⇌ H2(g) + CO2(g)
c) PCl5(g) ⇌ Cl2(g) + PCl3(g)
d) H2(g) + I2(g) ⇌ 2HI(g)
Nếu tăng áp suất và giữ nguyên nhiệt độ, các cân bằng trên chuyển dịch theo chiều nào? Giải thích.
c) Sản phẩm:
Câu trả lời cúa HS, dự kiến:
Câu hỏi 7 trang 10 SGK Hoá học 11:
Hằng số cân bằng KC của phản ứng tại t oC là:
KC =
Câu hỏi 8 trang 13 SGK Hoá học 11:
1. Cân bằng: CaCO3(s) ⇌ CaO(s) + CO2(g)
Þ Chiều thuận thu nhiệt.
Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều thuận, tức là chiều phản ứng thu nhiệt, nghĩa là chiều làm giảm tác động của việc tăng nhiệt độ.
2. Cân bằng: 2SO2(g) + O2(g) ⇌ 2SO3(g)
Þ Chiều thuận toả nhiệt.
Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều nghịch, tức là chiều phản ứng thu nhiệt, nghĩa là chiều làm giảm tác động của việc tăng nhiệt độ.
Câu hỏi 9 trang 13 SGK Hoá học 11:
a) Tăng nồng độ của C2H5OH, cân bằng sẽ chuyển dịch theo chiều thuận, tức chiều làm giảm nồng độ của C2H5OH.
b) Giảm nồng độ của CH3COOC2H5, cân bằng sẽ chuyển dịch theo chiều thuận, tức chiều làm tăng nồng độ CH3COOC2H5.
Câu hỏi 10 trang 14 SGK Hoá học 11:
a) 2SO2(g) + O2(g) ⇌ 2SO3(g)
Nếu tăng áp suất và giữ nguyên nhiệt độ, cân bằng sẽ chuyển dịch theo chiều thuận, tức chiều làm giảm áp suất (hay chiều làm giảm số mol khí).
b) CO(g) + H2O(g) ⇌ H2(g) + CO2(g)
Nếu tăng áp suất và giữ nguyên nhiệt độ, cân bằng sẽ không chuyển dịch, do đối với phản ứng thuận nghịch có tổng hệ số tỉ lượng của các chất khí ở hai vế của phương trình hoá học bằng nhau thì trạng thái cân bằng của hệ không bị chuyển dịch khi thay đổi áp suất chung của hệ.
c) PCl5(g) ⇌ Cl2(g) + PCl3(g)
Nếu tăng áp suất và giữ nguyên nhiệt độ, cân bằng sẽ chuyển dịch theo chiều nghịch, tức chiều làm giảm áp suất (hay chiều làm giảm số mol khí).
d) H2(g) + I2(g) ⇌ 2HI(g)
Nếu tăng áp suất và giữ nguyên nhiệt độ, cân bằng sẽ không chuyển dịch, do đối với phản ứng thuận nghịch có tổng hệ số tỉ lượng của các chất khí ở hai vế của phương trình hoá học bằng nhau thì trạng thái cân bằng của hệ không bị chuyển dịch khi thay đổi áp suất chung của hệ.
d) Tổ chức thực hiện:
Bước 1. Chuyển giao nhiệm vụ học tập
- GV yêu cầu HS làm việc cá nhân hoàn thành các câu hỏi 7 đến câu hỏi 10 - SGK Hoá học 11.
- HS nhận nhiệm vụ.
Bước 2. Thực hiện nhiệm vụ học tập
- HS làm việc cá nhân hoàn thành bài tập.
- GV theo dõi, đôn đốc và hỗ trợ HS khi cần thiết.
Bước 3. Báo cáo kết quả hoạt động và thảo luận
- Đại diện 4 HS trình bày 4 bài tập.
- Các HS còn lại theo dõi, góp ý (nếu có).
Bước 4. Đánh giá kết quả thực hiện nhiệm vụ
- GV tổng kết, chuẩn hoá kiến thức.
D. HOẠT ĐỘNG VẬN DỤNG
a) Mục tiêu:
- Phát triển năng lực tự học và năng lực tìm hiểu đời sống.
b) Nội dung:
HS làm việc cá nhân tại nhà, hoàn thành câu hỏi 12 – SGK Hoá học 15.
Câu hỏi 12 trang 15 SGK Hoá học 11: Trong cơ thể người, hemoglobin (Hb) kết hợp với oxygen theo phản ứng thuận nghịch được biểu diễn đơn giản như sau:
Hb + O2 ⇌ HbO2
Ở phổi, nồng độ oxygen lớn nhất nên cân bằng trên chuyển dịch sang phải, hemoglobin kết hợp với oxygen. Khi đến các mô, nồng độ oxygen thấp, cân bằng trên chuyển dịch sang trái, giải phóng oxygen. Nếu thiếu oxygen ở não, con người có thể bị đau đầu, chóng mặt.
a) Vận dụng nguyên lí chuyển dịch cân bằng Le Chatelie, em hãy đề xuất biện pháp để oxygen lên não được nhiều hơn?
b) Khi lên núi cao, một số người cũng gặp hiện tượng bị đau đầu, chóng mặt. Dựa vào cân bằng trên, em hãy giải thích hiện tượng này.
c) Sản phẩm:
Câu trả lời của HS, dự kiến:
Câu hỏi 12 trang 15 SGK Hoá học 11:
a) Để oxygen lên não nhiều hơn thì hàm lượng oxygen hít vào phổi cũng phải nhiều hơn. Một số biện pháp đề xuất để oxygen lên não nhiều hơn:
+ Tập thể dục và hít thở đúng cách.
+ Giảm lo âu, căng thẳng và có chế độ dinh dưỡng hợp lí.
+ Không hút thuốc lá, tránh xa nơi có khói thuốc.
+ Bảo vệ môi trường không khí trong lành, tránh ô nhiễm không khí.
+ Trồng nhiều cây xanh…
b) Khi lên núi cao, một số người cũng gặp hiện tượng bị đau đầu, chóng mặt. Do ở trên núi cao, hàm lượng oxygen loãng, dẫn đến khi đến các mô cân bằng: Hb + O2 ⇌ HbO2 chuyển dịch theo chiều nghịch, giải phóng oxygen.
d) Tổ chức thực hiện:
Bước 1. Chuyển giao nhiệm vụ học tập
- GV yêu cầu HS về nhà hoàn thiện Câu hỏi 12 trang 15 SGK Hoá học 11.
- HS nhận nhiệm vụ học tập.
Bước 2. Thực hiện nhiệm vụ học tập
- HS làm việc cá nhân, tại nhà.
Bước 3. Báo cáo kết quả hoạt động và thảo luận
- GV gọi ngẫu nhiên một số HS nộp sản phẩm.
Bước 4. Đánh giá kết quả thực hiện nhiệm vụ
- GV nhận xét, cho điểm với các bài làm tốt.
BÀI 2: CÂN BẰNG TRONG DUNG DỊCH NƯỚC
I. Mục tiêu
1) Kiến thức
- Nêu được khái niệm sự điện li, chất điện li, chất không điện li.
- Trình bày được thuyết Brϕnsted – Lowry về acid – base.
- Nêu được khái niệm và ý nghĩa của pH trong thực tiễn.
- Viết được biểu thức tính pH và biết cách sử dụng các chất chỉ thị để xác định pH bằng các chất chỉ thị phổ biến như chất chỉ thị màu, quỳ tím, phenolphthalein, …
- Nêu được nguyên tắc xác định nồng độ acid, base mạnh bằng phương pháp chuẩn độ.
- Thực hiện được thí nghiệm chuẩn độ acid – base; chuẩn độ dung dịch base mạnh (sodium hydroxide) bằng acid mạnh (hydrochloric acid).
- Trình bày được ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion Al3+; Fe3+ và .
2) Năng lực
a) Năng lực chung
- Năng lực tự chủ và tự học: Học sinh xác định đúng đắn động cơ, thái độ học tập, tự đánh giá và điều chỉnh được kế hoạch học tập; tự nhận ra được những sai sót và khắc phục.
- Năng lực giao tiếp: Tiếp thu kiến thức, trao đổi học hỏi bạn bè thông qua việc thực hiện nhiệm vụ các hoạt động cặp đôi, nhóm; có thái độ tôn trọng, lắng nghe, có phản ứng tích cực trong giao tiếp.
- Năng lực hợp tác: Học sinh xác định được nhiệm vụ của tổ/ nhóm, trách nhiệm của bản thân, đề xuất được những ý kiến đóng góp, góp phần hoàn thành nhiệm vụ học tập.
b) Năng lực chuyên biệt
- Năng lực nhận thức hóa học: nêu được khái niệm sự điện li, chất điện li, chất không điện li, thuyết Brϕnsted – Lowry về acid – base, khái niệm pH …
- Năng lực tìm hiểu thế giới tự nhiên dưới góc độ hóa học: nêu được ý nghĩa của pH trong thực tiễn, liên hệ giá trị pH ở các bộ phận trong cơ thể với sức khoẻ con người, pH của đất, nước, tới sự phát triển của động, thực vật, ….
- Năng lực vận dụng kiến thức, kỹ năng đã học: sử dụng các chất chỉ thị để xác định pH của các dung dịch, thực hiện được thí nghiệm chuẩn độ acid – base …
3) Phẩm chất
- Trách nhiệm: nghiêm túc thực hiện các nhiệm vụ học tập được giao đúng tiến độ.
- Trung thực: thành thật trong việc thu thập các tài liệu, viết báo cáo và các bài tập.
- Chăm chỉ: tích cực trong các hoạt động cá nhân, tập thể.
- Nhân ái: quan tâm, giúp đỡ, chia sẻ những khó khăn trong việc thực hiện nhiệm vụ học tập.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
1. Giáo viên
- 6 bộ dụng cụ, hoá chất thí nghiệm tìm hiểu về sự điện li (cho 6 nhóm).
- 6 bộ dụng cụ cho thí nghiệm làm chất chỉ thị màu từ hoa đậu biếc/ bắp cải tím.
- 6 bộ dụng cụ, hoá chất cho thí nghiệm chuẩn độ acid, base.
- Giấy chỉ thị, máy đo pH.
- Thiết kế phiếu học tập, slide, máy tính, máy chiếu …
2. Học sinh
- Các nhóm HS chủ động phân công thành viên mang: hoa đậu biếc/ bắp cải tím; cốc nhựa; băng dính, giấy note (để dán nhãn cốc nhựa); giấm ăn, nước C sủi, nước rửa bát, nước soda, nước muối.
- SGK, vở ghi …
III. TIẾN TRÌNH DẠY HỌC
A. HOẠT ĐỘNG KHỞI ĐỘNG
Hoạt động 1: Mở đầu
a. Mục tiêu: Khơi gợi kiến thức cũ, tạo tâm thế hứng thú cho học sinh và từng bước làm quen bài mới.
b. Nội dung:
HS thảo luận theo cặp đôi, trả lời câu hỏi mở đầu, từ đó hình thành mục tiêu học tập.
|
CÂU HỎI MỞ ĐẦU Hình 2.1 cho thấy giá trị pH của dung dịch một số chất thông dụng. Vậy pH là gì? pH có ảnh hưởng gì đến đời sống? Xác định pH như thế nào? 
|
c. Sản phẩm:
Câu trả lởi của HS, dự kiến:
pH là một đại lượng liên hệ trực tiếp với nồng độ H+ để đánh giá tính acid, base của một dung dịch đã cho, với quy ước như sau:
pH = -log[H+] hoặc [H+] = 10-pH
Chỉ số pH có ý nghĩa to lớn trong thực tiễn, pH có liên quan đến sức khoẻ con người, sự phát triển của động, thực vật, …
Ví dụ:
+ Cá ưa sống trong môi trường nước có pH khoảng 7,5 – 8,5.
+ Một số loại thực vật chỉ phát triển tốt trong đất có giá trị pH thích hợp.
d. Tổ chức thực hiện:
Bước 1. Chuyển giao nhiệm vụ học tập
- GV yêu cầu HS làm việc theo cặp đôi, trả lời câu hỏi mở đầu.
- HS nhận nhiệm vụ.
Bước 2. Thực hiện nhiệm vụ học tập
- HS thảo luận theo cặp đôi trả lời câu hỏi.
- GV theo dõi, đôn đốc và hỗ trợ HS khi cần thiết.
Bước 3. Báo cáo kết quả hoạt động và thảo luận
- Đại diện 1 HS trả lời, các HS còn lại chú ý lắng nghe, nhận xét (nếu có).
Bước 4. Đánh giá kết quả thực hiện nhiệm vụ
- Câu trả lời của HS có thể đúng hoặc sai, GV không nhận xét tính đúng/ sai mà căn cứ vào đó để dẫn dắt vào bài mới.
B. HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC MỚI
Hoạt động 2: Tìm hiểu sự điện li
a) Mục tiêu:
Nêu được khái niệm sự điện li.
b) Nội dung:
HS làm việc theo nhóm, thực hiện thí nghiệm thử tính dẫn điện của nước, muối ăn và dung dịch muối ăn, từ đó hoàn thành các câu hỏi ở phiếu học tập 1, lĩnh hội kiến thức.
|
PHIẾU HỌC TẬP SỐ 1 Lắp bộ dụng cụ thí nghiệm như mô tả ảnh sau và trả lời các câu hỏi bên dưới: 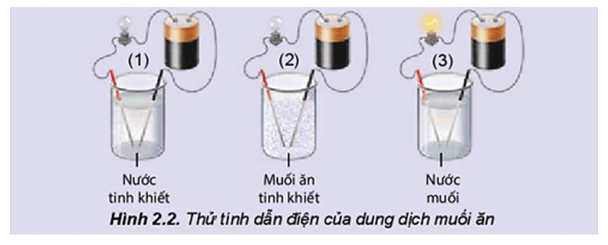
Câu 1. Hãy nhắc lại khái niệm dòng điện. Câu 2. Đèn sáng cho thấy dung dịch NaCl dẫn điện, chứng tỏ dung dịch có hạt mang điện. Đó có thể là loại hạt nào (electron, phân tử NaCl, cation hay anion)? Câu 3. Hãy giải thích sự tạo thành các hạt mang điện đó. |
c) Sản phẩm:
Câu trả lời của HS, dự kiến:
Câu 1: Dòng điện là dòng dịch chuyển có hướng của các hạt mang điện.
Câu 2: Đèn sáng cho thấy dung dịch NaCl dẫn điện, chứng tỏ dung dịch có hạt mang điện. Đó có thể là cation và anion.
Câu 3:
Giải thích:
NaCl là hợp chất ion, trong tinh thể có các ion Na+ và Cl- liên kết với nhau bằng lực hút tĩnh điện. Nước là một dung môi phân cực. Khi cho tinh thể NaCl vào nước, các ion Na+ và Cl- trên bề mặt hút các phân tử nước lại gần. Các phân tử nước hướng các đầu âm vào ion Na+, các đầu dương vào ion Cl- và làm yếu liên kết giữa các cation, anion trong tinh thể và khuếch tán vào nước.
d) Tổ chức thực hiện:
|
HOẠT ĐỘNG CỦA GV VÀ HS |
NỘI DUNG |
|
Bước 1. Chuyển giao nhiệm vụ học tập - GV chia lớp làm 6 nhóm, yêu cầu các nhóm thực hiện thí nghiệm thử tính dẫn điện của nước, muối ăn và dung dịch muối ăn như mô tả trong SGK hoặc phiếu học tập số 1, sau đó trả lời các câu hỏi có trong phiếu học tập. - HS nhận nhiệm vụ. Bước 2. Thực hiện nhiệm vụ học tập - HS làm việc theo nhóm thực hiện thí nghiệm và hoàn thiện các câu hỏi trong phiếu học tập. - GV quan sát, đôn đốc và hỗ trợ HS khi cần thiết. Bước 3. Báo cáo kết quả hoạt động và thảo luận - 2 HS đại diện 2 nhóm trình bày kết quả thảo luận, các HS còn lại theo dõi và nhận xét (nếu có). Bước 4. Đánh giá kết quả thực hiện nhiệm vụ - GV tổng kết, chuẩn hoá kiến thức, từ đó dẫn dắt vào khái niệm sự điện li. |
I. Sự điện li 1. Hiện tượng điện li Quá trình phân li các chất trong nước tạo thành ion được gọi là sự điện li. Những chất khi tan trong nước phân li ra ion được gọi là các chất điện li. |
Hoạt động 3: Tìm hiểu chất điện li
a) Mục tiêu:
- Nêu được khái niệm chất điện li và chất không điện li.
b) Nội dung:
- Học sinh làm việc theo nhóm thực hành thí nghiệm và hoàn thành phiếu học tập số 2. Từ đó lĩnh hội kiến thức.
|
PHIẾU HỌC TẬP SỐ 2 Thí nghiệm 1: Thực hiện thí nghiệm thử tính dẫn điện với các dung dịch hydrochloric acid (HCl); sodium hydroxide (NaOH); saccharose (C12H22O11); ethanol (C2H5OH) và hoàn thành bảng sau: 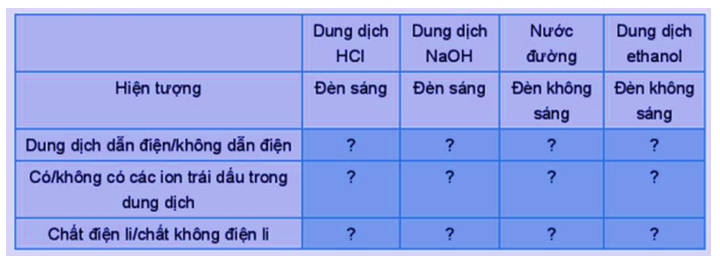
Thí nghiệm 2: Thực hiện thí nghiệm thử tính dẫn điện với các dung dịch HCl 0,1M và CH3COOH 0,1M. Cho biết: - Bóng đèn ở cốc đựng dung dịch nào sáng hơn? - So sánh số ion mang điện trong hai dung dịch, từ đó cho biết acid nào phân li mạnh hơn? |
c) Sản phẩm:
Câu trả lời của HS, dự kiến:
Thí nghiệm 1:
|
|
Dung dịch HCl |
Dung dịch NaOH |
Nước đường |
Dung dịch ethanol |
|
Hiện tượng |
Đèn sáng |
Đèn sáng |
Đèn không sáng |
Đèn không sáng |
|
Dung dịch dẫn điện/không dẫn điện |
Dung dịch dẫn điện |
Dung dịch dẫn điện |
Dung dịch không dẫn điện |
Dung dịch không dẫn điện |
|
Có/không có các ion trái dấu trong dung dịch |
Có ion trái dấu trong dung dịch |
Có ion trái dấu trong dung dịch |
Không có ion trái dấu trong dung dịch |
Không có ion trái dấu trong dung dịch |
|
Chất điện li/chất không điện li |
Chất điện li |
Chất điện li |
Chất không điện li |
Chất không điện li |
Thí nghiệm 2:
Hai dung dịch HCl và CH3COOH có cùng nồng độ là 0,1 M. Trường hợp cốc đựng dung dịch HCl 0,1 M bóng đèn sáng hơn Þ số hạt mang điện trong dung dịch HCl nhiều hơn số hạt mang điện trong dung dịch CH3COOH 0,1 M.
Vậy acid HCl phân li mạnh hơn.
d) Tổ chức thực hiện:
|
HOẠT ĐỘNG CỦA GV VÀ HS |
NỘI DUNG |
|
Nhiệm vụ 1: Tìm hiểu chất điện li và chất không điện li Bước 1. Chuyển giao nhiệm vụ học tập - GV yêu cầu học sinh làm việc theo nhóm, thực hiện thí nghiệm 1 và hoàn thiện yêu cầu kèm theo TN này trong phiếu học tập số 2. Từ đó rút ra khái niệm chất điện li và chất không điện li. - HS nhận nhiệm vụ. Bước 2. Thực hiện nhiệm vụ học tập - HS làm thí nghiệm và hoàn thành phiếu học tập. - GV theo dõi, đôn đốc và hỗ trợ HS khi cần thiết. Bước 3. Báo cáo kết quả hoạt động và thảo luận - Đại diện 2 nhóm báo cáo kết quả. - Các HS còn lại theo dõi, nhận xét (nếu có). Bước 4. Đánh giá kết quả thực hiện nhiệm vụ - GV tổng kết, chuẩn hoá kiến thức. Từ đó dẫn dắt HS hình thành khái niệm chất điện li và chất không điện li. Nhiệm vụ 2: Tìm hiểu chất điện li mạnh và chất điện li yếu Bước 1. Chuyển giao nhiệm vụ học tập - GV yêu cầu học sinh làm việc theo nhóm, thực hiện thí nghiệm 2 và hoàn thiện yêu cầu kèm theo TN này trong phiếu học tập số 2. Từ đó rút ra khái niệm chất điện li mạnh và chất điện li yếu và viết phương trình điện li. - HS nhận nhiệm vụ. Bước 2. Thực hiện nhiệm vụ học tập - HS làm thí nghiệm và hoàn thành phiếu học tập. - GV theo dõi, đôn đốc và hỗ trợ HS khi cần thiết. Bước 3. Báo cáo kết quả hoạt động và thảo luận - Đại diện 2 nhóm báo cáo kết quả. - Các HS còn lại theo dõi, nhận xét (nếu có). Bước 4. Đánh giá kết quả thực hiện nhiệm vụ - GV tổng kết, chuẩn hoá kiến thức. Từ đó dẫn dắt HS hình thành khái niệm chất điện li mạnh và chất điện li yếu và viết phương trình điện li. |
2. Chất điện li a) Chất điện li và chất không điện li - Chất điện li là chất tan trong nước phân li ra ion. Ví dụ: hydrochloric acid; sodium hydroxide … - Chất không điện li là chất khi tan trong nước không phân li ra ion. Ví dụ: saccarose, ethanol… Sự phân li một chất thành các ion mang điện tích trái dấu trong dung dịch được biểu diễn bằng phương trình điện li. Ví dụ: NaOH(aq) → Na+(aq) + OH-(aq)
b) Tìm hiểu chất điện li mạnh và chất điện li yếu - Chất điện li mạnh là chất khi tan trong nước, hầu hết các phân tử chất tan đều phân li ra ion. Các chất điện li mạnh thường gặp là: Các acid mạnh: HCl; HNO3; H2SO4, … Các base mạnh: NaOH; KOH … Hầu hết các muối. Quá trình phân li của chất điện li mạnh xảy ra gần như hoàn toàn và được biểu diễn bằng một mũi tên một chiều: HNO3 → H+ + NO3- - Chất điện li yếu là chất khi tan trong nước chỉ có một phần số phân tử chất tan phân li ra ion, phần còn lại vẫn tồn tại ở dạng phân tử trong dung dịch. Những chất điện li yếu như: acid yếu CH3COOH; HClO; HF; H2CO3 …; base yếu như Cu(OH)2; Fe(OH)2 … Quá trình phân li của chất điện li yếu là một phản ứng thuận nghịch và được biểu diễn bằng hai nửa mũi tên ngược chiều nhau: CH3COOH ⇌ CH3COO- + H+
|
Hoạt động 4: Tìm hiểu thuyết acid – base của Brϕnsted – Lowry
a) Mục tiêu:
- Trình bày được thuyết acid – base của Brϕnsted – Lowry.
b) Nội dung:
- HS làm việc theo nhóm, hoàn thành phiếu học tập số 3 từ đó lĩnh hội kiến thức.
|
PHIẾU HỌC TẬP SỐ 3 Câu 1: Cho các dung dịch: HCl, NaOH, Na2CO3. a) Viết phương trình điện li của các chất trên. b) Sử dụng máy đo pH (hoặc giấy pH) xác định pH, môi trường (acid/base) của các dung dịch trên. c) Theo khái niệm acid – base trong môn Khoa học tự nhiên ở lớp 8, trong những chất cho ở trên: Chất nào là acid? Chất nào là base? Câu 2: Nêu định nghĩa acid – base theo Brϕnsted – Lowry. Dựa vào thuyết acid – base của Br∅nsted – Lowry, hãy xác định chất nào là acid, chất nào là base trong các phản ứng sau: a) CH3COOH + H2O ⇌ CH3COO- + H3O+ b) S2- + H2O ⇌ HS- + OH- |
c) Sản phẩm:
Câu trả lời của HS, dự kiến:
Câu 1:
a) Phương trình điện li của các chất:
HCl → H+ + Cl-
NaOH → Na+ + OH-
Na2CO3 → 2Na+ +
b) Học sinh sử dụng máy đo xác định pH, tham khảo kết quả sau:
|
Dung dịch |
HCl (0,01 M) |
NaOH (0,01 M) |
Na2CO3 (0,01 M) |
|
pH |
2 |
12 |
11,17 |
|
Môi trường |
acid |
base |
base |
c) Trong môn Khoa học tự nhiên 8:
- Acid là những hợp chất trong phân tử có nguyên tử hydrogen liên kết với gốc acid. Khi tan trong nước, acid tạo ra ion H+.
- Base là những hợp chất trong phân tử có nguyên tử kim loại liên kết với nhóm hydroxide. Khi tan trong nước, base tạo ra ion OH-.
Þ Theo khái niệm acid – base trong môn Khoa học tự nhiên ở lớp 8, HCl là acid; NaOH là base.
Câu 2:
Thuyết Br∅nsted – Lowry cho rằng acid là chất cho proton (H+) và base là chất nhận proton.
a) CH3COOH + H2O ⇌ CH3COO- + H3O+
Trong phản ứng trên: CH3COOH cho H+, CH3COOH là acid; H2O nhận H+, H2O là base.
b) S2- + H2O ⇌ HS- + OH-
Trong phản ứng trên: H2O cho H+, H2O là acid; S2- nhận H+, S2- là base.
d) Tổ chức thực hiện:
|
HOẠT ĐỘNG CỦA GV VÀ HS |
NỘI DUNG |
|
Bước 1. Chuyển giao nhiệm vụ học tập - GV yêu cầu học sinh làm việc theo nhóm, nghiên cứu SGK và hoàn thiện phiếu học tập số 3. - HS nhận nhiệm vụ. Bước 2. Thực hiện nhiệm vụ học tập - HS làm việc nhóm, hoàn thành phiếu học tập. - GV theo dõi, đôn đốc và hỗ trợ HS khi cần thiết. Bước 3. Báo cáo kết quả hoạt động và thảo luận - Đại diện 2 nhóm báo cáo kết quả (mỗi nhóm báo cáo 1 câu). - Các HS còn lại theo dõi, nhận xét (nếu có). Bước 4. Đánh giá kết quả thực hiện nhiệm vụ - GV tổng kết, chuẩn hoá kiến thức và nêu ưu điểm của thuyết Br∅nsted – Lowry. |
II. Thuyết acid – base của Brϕnsted – Lowry. 1. Khái niệm acid và base theo thuyết Brϕnsted – Lowry. Thuyết Brϕnsted – Lowry cho rằng acid là chất cho proton (H+) và base là chất nhận proton (H+). 2. Ưu điểm của thuyết Brϕnsted – Lowry Thuyết Brϕnsted – Lowry tổng quát hơn thuyết Arrhenius, phân tử không có nhóm OH như NH3 hoặc ion như CO32- cũng là base.
|
Hoạt động 5: Tìm hiểu khái niệm pH và ý nghĩa của pH trong thực tiễn.
a) Mục tiêu:
- Nêu được khái niệm pH và ý nghĩa của pH trong thực tiễn.
b) Nội dung:
- Học sinh làm việc theo nhóm, hoàn thiện phiếu học tập số 4 từ đó lĩnh hội kiến thức.
|
PHIẾU HỌC TẬP SỐ 4 1. pH của dung dịch được xác định như thế nào? Mối liên hệ giữa pH và môi trường dung dịch? 2. Một loại dầu gội đầu có nồng độ ion OH- là 10-5,17 mol/ L. a) Tính nồng độ ion H+, pH của loại dầu gội nói trên. b) Môi trường của loại dầu gội trên là acid, base hay trung tính? 3. pH của dung dịch nào sau đây có giá trị nhỏ nhất? A. Dung dịch HCl 0,1 M. B. Dung dịch CH3COOH 0,1 M. C. Dung dịch NaCl 0,1 M. D. Dung dịch NaOH 0,01 M. 4. Nêu ý nghĩa của pH trong thực tiễn? |
c) Sản phẩm:
- Câu trả lời của học sinh. Dự kiến:
1. pH = -log[H+] hoặc [H+] = 10-pH.
Trong đó [H+] là nồng độ mol của ion H+.
Nếu dung dịch có [H+] = 10-a mol/ L thì pH = a.
Mối liên hệ giữa pH và môi trường dung dịch:
Môi trường acid: pH < 7.
Môi trường base: pH > 7.
Môi trường trung tính: pH = 7.
2.
a) Ta có: [H+].[OH]- = 10-14
Ta có: pH = -log[H+] = 8,83.
b) pH > 7 nên môi trường của loại dầu gội trên là base.
3.
Đáp án đúng là: A
|
Dung dịch |
HCl 0,1 M |
CH3COOH 0,1 M |
NaCl 0,1 M |
NaOH 0,01 M |
|
pH |
1 |
> 1 |
7 |
12 |
4. Chỉ số pH có ý nghĩa to lớn trong thực tiễn, pH có liên quan đến sức khoẻ của con người, sự phát triển của động vật, thực vật.
d) Tổ chức thực hiện:
|
HOẠT ĐỘNG CỦA GV VÀ HS |
NỘI DUNG |
|
Bước 1. Chuyển giao nhiệm vụ học tập - GV yêu cầu học sinh làm việc theo nhóm, nghiên cứu SGK và hoàn thiện phiếu học tập số 4. - HS nhận nhiệm vụ. Bước 2. Thực hiện nhiệm vụ học tập - HS làm việc nhóm, hoàn thành phiếu học tập. - GV theo dõi, đôn đốc và hỗ trợ HS khi cần thiết. Bước 3. Báo cáo kết quả hoạt động và thảo luận - Đại diện 2 nhóm báo cáo kết quả (mỗi nhóm báo cáo 2 câu). - Các HS còn lại theo dõi, nhận xét (nếu có). Bước 4. Đánh giá kết quả thực hiện nhiệm vụ - GV tổng kết, chuẩn hoá kiến thức. |
III. Khái niệm pH và ý nghĩa của pH trong thực tiễn 1. Khái niệm pH pH = -log[H+] hoặc [H+] = 10-pH. Trong đó [H+] là nồng độ mol của ion H+. Nếu dung dịch có [H+] = 10-a mol/ L thì pH = a. Mối liên hệ giữa pH và môi trường dung dịch: Môi trường acid: pH < 7. Môi trường base: pH > 7. Môi trường trung tính: pH = 7. 2. Ý nghĩa của pH trong thực tiễn Chỉ số pH có ý nghĩa to lớn trong thực tiễn, pH có liên quan đến sức khoẻ của con người, sự phát triển của động vật, thực vật.
|
Hoạt động 6: Tìm hiểu cách xác định pH
a) Mục tiêu:
- Biết cách sử dụng máy đo pH để xác định pH dung dịch.
- Biết cách sử dụng chỉ thị để xác định pH bằng các chất chỉ thị phổ biến như giấy chỉ thị màu, quỳ tím, phenolphthalein…
b) Nội dung:
- HS làm việc theo nhóm, thực hiện hoạt động “làm chất chỉ thị màu từ hoa đậu biếc/ bắp cải tím”.
Chuẩn bị:
Phần của HS (GV dặn từ buổi trước):
- Hoa đậu biếc (khoảng 50 g) hoặc bắp cải tím thái nhỏ (khoảng 100 g).
- Các cốc (đã được dán nhãn) đựng giấm ăn, nước C sủi, nước rửa bát, nước soda, nước muối.
Phần của GV:
- Cốc thuỷ tinh 250 mL, nước sôi, đũa thuỷ tinh, lưới/ vải lọc.
- Giấy pH hoặc máy đo pH.
Tiến hành:
– Ngâm khoảng 50 g hoa đậu biếc/100 g bắp cải tím đã được chuẩn bị vào 100 mL nước sôi trong khoảng 10 phút. Lọc bằng lưới lọc hoặc vải lọc, thu được dung dịch. Dung dịch này được sử dụng làm chất chỉ thị.
– Dùng máy đo pH (hoặc giấy pH) xác định pH của các dung dịch.
- Cho vài giọt chất chỉ thị lần lượt vào các dung dịch: giấm ăn, nước C sủi, nước rửa bát, nước soda, nước muối và khuấy đều. Quan sát sự đổi màu của các dung dịch.
Hoàn thành thông tin theo mẫu bảng sau vào vở:
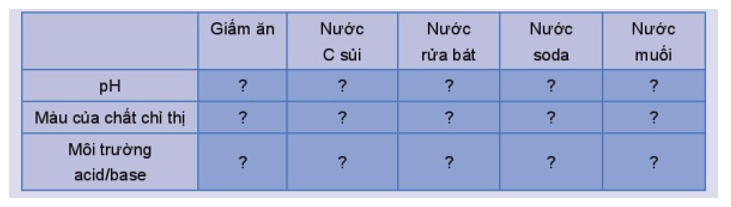
c) Sản phẩm:
Kết quả làm việc nhóm của HS, dự kiến:
|
|
Giấm ăn |
Nước C sủi |
Nước rửa bát |
Nước soda |
Nước muối |
|
pH |
3 |
3,5 |
9,5 |
3,8 |
7 |
|
Màu của chất chỉ thị |
Đỏ tím |
Đỏ tím |
Xanh vàng |
Đỏ tím |
Không đổi màu |
|
Môi trường acid/ base |
Acid |
Acid |
Base |
Acid |
Trung tính |
d) Tổ chức thực hiện:
Bước 1. Chuyển giao nhiệm vụ học tập
- GV yêu cầu học sinh đọc cách tiến hành thí nghiệm. Sau đó GV hệ thống lại và nêu quy tắc khi làm thực hành.
- Yêu cầu HS tiến hành theo nhóm: “làm chất chỉ thị màu từ hoa đậu biếc/ bắp cải tím” theo hướng dẫn trong SGK.
- HS nhận nhiệm vụ.
Bước 2. Thực hiện nhiệm vụ học tập
- HS làm việc theo nhóm, thực hiện nhiệm vụ.
- GV theo dõi, đôn đốc và hỗ trợ học sinh khi cần thiết.
Bước 3. Báo cáo kết quả hoạt động và thảo luận
- Lần lượt từng nhóm báo cáo kết quả hoạt động.
- Các nhóm khác theo dõi.
Bước 4. Đánh giá kết quả thực hiện nhiệm vụ
- GV tổng kết, chuẩn hoá kiến thức.
Hoạt động 7: Tìm hiểu sự thuỷ phân của các ion
a) Mục tiêu:
- Nêu được khái niệm phản ứng thuỷ phân.
- Trình bày được ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion Al3+, Fe3+ và CO32-.
b) Nội dung:
- Học sinh làm việc theo cặp đôi, nghiên cứu SGK, hoàn thành phiếu học tập số 5, từ đó lĩnh hội kiến thức:
|
PHIẾU HỌC TẬP SỐ 5 1. Thể nào là phản ứng thuỷ phân? 2. Giải thích về môi trường của các dung dịch: Na2CO3, AlCl3, FeCl3. |
c) Sản phẩm:
Câu trả lời của học sinh, dự kiến:
1. Khi tan trong nước, muối phân li thành các ion. Phản ứng giữa ion với nước tạo ra các dung dịch có môi trường khác nhau được gọi là phản ứng thuỷ phân.
2. Giải thích:
- Trong dung dịch Na2CO3, ion Na+ không bị thuỷ phân, còn ion thuỷ phân trong nước tạo ra ion OH- theo phương trình:
Vậy dung dịch Na2CO3 có môi trường base.
- Trong dung dịch AlCl3 và FeCl3, ion Cl- không bị thuỷ phân, các ion Al3+ và Fe3+ bị thuỷ phân trong nước tạo ra ion H+ theo phương trình ở dạng đơn giản như sau:
Al3+ + H2O ⇌ Al(OH)2+ + H+
Fe3+ + H2O ⇌ Fe(OH)2+ + H+
Vậy các dung dịch AlCl3 và FeCl3 có môi trường acid.
d) Tổ chức thực hiện:
|
HOẠT ĐỘNG CỦA GV VÀ HS |
NỘI DUNG |
|
Bước 1. Chuyển giao nhiệm vụ học tập - GV yêu cầu học sinh làm việc theo cặp đôi, nghiên cứu SGK và hoàn thiện phiếu học tập số 5. - HS nhận nhiệm vụ. Bước 2. Thực hiện nhiệm vụ học tập - HS làm việc cặp đôi, hoàn thành phiếu học tập. - GV theo dõi, đôn đốc và hỗ trợ HS khi cần thiết. Bước 3. Báo cáo kết quả hoạt động và thảo luận - Đại diện 2 HS báo cáo kết quả (mỗi HS báo cáo 1 câu). - Các HS còn lại theo dõi, nhận xét (nếu có). Bước 4. Đánh giá kết quả thực hiện nhiệm vụ - GV tổng kết, chuẩn hoá kiến thức. |
IV. SỰ THUỶ PHÂN CỦA CÁC ION Khi tan trong nước, muối phân li thành các ion. Phản ứng giữa ion với nước tạo ra các dung dịch có môi trường khác nhau được gọi là phản ứng thuỷ phân. Ví dụ: - Trong dung dịch Na2CO3, ion Na+ không bị thuỷ phân, còn ion thuỷ phân trong nước tạo ra ion OH- theo phương trình: Vậy dung dịch Na2CO3 có môi trường base. |
Hoạt động 7: Tìm hiểu nguyên tắc và thực hành chuẩn độ acid – base (hoạt động này được tiến hành tại phòng thí nghiệm)
a) Mục tiêu:
- Nêu được nguyên tắc xác định nồng độ acid, base mạnh bằng phương pháp chuẩn độ.
- Thực hiện được thí nghiệm chuẩn độ acid – base: Chuẩn độ dung dịch base mạnh (sodium hydroxide) bằng acid mạnh (hydrochloric acid).
b) Nội dung:
Học sinh tiến hành thí nghiệm tại PTN của nhà trường, dưới sự hướng dẫn của GV, hoàn thành mẫu báo cáo thực hành sau:
|
Họ và tên: Lớp: BÁO CÁO THỰC HÀNH Chuẩn độ dung dịch base mạnh (sodium hydroxide) bằng acid mạnh (hydrochloric acid) I. Nguyên tắc chung …………………………………………………………………………………………………………………………………………………………………………………… …………………………………………………………………………………………………………………………………………………………………………………… II. Hoá chất, dụng cụ 1. Hoá chất …………………………………………………………………………………………………………………………………………………………………………………… 2. Dụng cụ …………………………………………………………………………………………………………………………………………………………………………………… III. Cách tiến hành …………………………………………………………………………………………………………………………………………………………………………………… …………………………………………………………………………………………………………………………………………………………………………………… IV. Kết quả thí nghiệm …………………………………………………………………………………………………………………………………………………………………………………… …………………………………………………………………………………………………………………………………………………………………………………… V. Trả lời câu hỏi 1. Nêu một số điểm cần chú ý trong quá trình chuẩn độ. 2. Nêu một số nguyên nhân có thể dẫn đến sai số trong quá trình chuẩn độ. |
c) Sản phẩm:
Báo cáo thực hành của học sinh, dự kiến:
Họ và tên:
Lớp:
BÁO CÁO THỰC HÀNH
Chuẩn độ dung dịch base mạnh (sodium hydroxide) bằng acid mạnh (hydrochloric acid)
I. Nguyên tắc chung
- Chuẩn độ là phương pháp xác định nồng độ của một chất bằng dung dịch chuẩn đã biết nồng độ.
- Chuẩn độ dung dịch base mạnh (sodium hydroxide) bằng acid mạnh (hydrochloric acid):
Phương trình phản ứng: NaOH + HCl → NaCl + H2O
Khi các chất phản ứng vừa đủ với nhau, số mol HCl phản ứng bằng số mol NaOH.
Ta có: VHCl. CHCl = VNaOH. CNaOH]
Trong đó:
CHCl và CNaOH lần lượt là nồng độ mol của dung dịch HCl và dung dịch NaOH;
VHCl và VNaOH lần lượt là thể tích dung dịch HCl và dung dịch NaOH (cùng đơn vị đo).
Khi biết VHCl, VNaOH trong quá trình chuẩn độ và biết CHCl sẽ tính được CNaOH.
Thời điểm để kết thúc chuẩn độ được xác định bằng sự đổi màu của chất chỉ thị phenolphthalein.
II. Hoá chất, dụng cụ
1. Hoá chất
Dung dịch HCl 0,1 M; dung dịch NaOH nồng độ khoảng 0,1 M; dung dịch phenolphthalein.
2. Dụng cụ
Pipette 10 mL; burette 25 mL; bình tam giác 100 mL; bình tia nước cất; giá đỡ, kẹp burrete.
III. Cách tiến hành
– Dùng pipette lấy 10 mL dung dịch HCl 0,1 M cho vào bình tam giác, thêm 1 – 2 giọt phenolphthalein.
– Cho dung dịch NaOH vào burette, điều chỉnh dung dịch trong burette về mức 0.
– Mở khoá burette, nhỏ từng giọt dung dịch NaOH xuống bình tam giác (lắc đều trong quá trình chuẩn độ) đến khi dung dịch xuất hiện màu hồng nhạt (bền trong khoảng 10 giây) thì dừng chuẩn độ.
- Ghi lại thể tích dung dịch NaOH đã dùng.
Tiến hành chuẩn độ ít nhất ba lần, ghi số liệu thực nghiệm và hoàn thành vào vở theo mẫu bảng sau:

IV. Kết quả thí nghiệm
- HS làm thí nghiệm và ghi kết quả.
V. Trả lời câu hỏi
1. Một số điểm cần chú ý trong quá trình chuẩn độ:
- Tránh để các hoá chất như dung dịch HCl, dung dịch NaOH bắn vào tay, mắt.
- Các dụng cụ thuỷ tinh (bình tam giác, burette, pipette …) dễ vỡ, cần cẩn thận.
2. Một số nguyên nhân có thể dẫn đến sai số trong quá trình chuẩn độ:
+ Sai số do phương pháp hay quy trình chuẩn độ: phản ứng hoá học không hoàn toàn, chỉ thị đổi màu khi chưa đến điểm tương đương …
+ Sai số do dụng cụ như: dụng cụ chưa được rửa sạch, dụng cụ chưa được chuẩn hoá…
+ Sai số do người làm thí nghiệm: mắt nhìn không chính xác, cẩu thả trong thực nghiệm …
+ Sai số do hoá chất không tinh khiết.
d) Tổ chức thực hiện:
Bước 1. Chuyển giao nhiệm vụ học tập
Nhiệm vụ giao HS làm ở nhà từ tiết trước: HS nghiên cứu SGK hoàn thành trước các mục I, II, III, V trong báo cáo thực hành. Để lại mục IV để sau khi thí nghiệm thì hoàn thiện.
Nhiệm vụ trong buổi học: GV nêu lại nội quy trong phòng thí nghiệm, yêu cầu HS làm việc theo nhóm, tiến hành thí nghiệm theo nội dung trong SGK.
HS nhận nhiệm vụ.
Bước 2. Thực hiện nhiệm vụ học tập
- HS thực hiện nhiệm vụ.
- GV theo dõi, đôn đốc và hỗ trợ học sinh khi cần thiết.
Bước 3. Báo cáo kết quả hoạt động và thảo luận
- GV yêu cầu học sinh thu dọn vệ sinh vị trí thí nghiệm, hoàn thiện mục IV trong báo cáo thực hành và nộp lại báo cáo cho GV.
Bước 4. Đánh giá kết quả thực hiện nhiệm vụ
- GV nhận xét tổng quan cho buổi học, chấm báo cáo của HS và trả bài vào tiết sau.
C. HOẠT ĐỘNG LUYỆN TẬP
a) Mục tiêu:
- Hệ thống được một số kiến thức đã học.
b) Nội dung:
- Học sinh làm việc theo cặp đôi, hoàn thành phiếu bài tập sau:
PHIẾU BÀI TẬP
Câu 1: Dung dịch nào sau đây có khả năng dẫn điện?
A. Dung dịch đường. B. Dung dịch rượu.
C. Dung dịch muối ăn. D. Nước cất.
Câu 2: Dung dịch chất nào sau đây không dẫn điện được?
A. C6H6 (benzene). B. Ca(OH)2 trong nước.
C. CH3COONa trong nước. D. NaHSO4 trong nước.
Câu 3: Chất nào dưới đây không phân li ra ion khi hòa tan trong nước?
A. MgCl2. B. HClO4.
C. Ba(OH)2. D. C6H12O6.
Câu 4: Chất nào sau đây thuộc loại chất điện li mạnh?
A. CH3COOH. B. C2H5OH.
C. H2O. D. NaCl.
Câu 5: Trong dung dịch CH3COOH loãng (bỏ qua sự phân li của H2O) có những phần tử nào?
A. H+, CH3COO-.
B. H+, CH3COO-, H2O.
C. CH3COOH, H+, CH3COO-, H2O.
D. CH3COOH, CH3COO-, H+.
Câu 6: Phương trình điện li viết đúng là
A. NaCl → Na2+ + Cl2-
B. Ca(OH)2 → Ca2+ + 2OH-
C. C2H5OH → C2H5+ + OH-
D. CH3COOH → CH3COO- + H+
Câu 7: Chất nào sau đây là acid theo Bronsted – Lowry?
A. NH3. B. NaCl.
C. CH3COOH. D. NaOH.
Câu 8: Môi trường trung tính là môi trường có
A. pH = 0. B. pH = 7.
C. pH > 7. D. pH < 7.
Câu 9: Đo PH của một cốc nước chanh được giá trị pH bằng 2,4. Nhận định nào sau đây không đúng?
A. Nước chanh có môi trường acid.
B. Nồng độ ion [H+] của nước chanh là 10-2,4 mol/L.
C. Nồng độ ion [H+] của nước chanh là 0,24 mol/L.
D. Nồng độ của ion [OH-] của nước chanh nhỏ hơn 10-7 mol/L.
Câu 10: Các dung dịch NaCl, NaOH, NH3, Ba(OH)2 có cùng nồng độ mol, dung dịch có
pH lớn nhất là
A. NaOH. B. Ba(OH)2. C. NH3. D. NaCl.
c) Sản phẩm:
|
1 - C |
2 - A |
3 - D |
4 - D |
5 - C |
6 - B |
7 - C |
8 - B |
9 - C |
10 - B |
d) Tổ chức thực hiện:
Bước 1. Chuyển giao nhiệm vụ học tập
- GV yêu cầu HS làm việc theo cặp đôi, hoàn thành phiếu bài tập.
- HS nhận nhiệm vụ.
Bước 2. Thực hiện nhiệm vụ học tập
- Học sinh làm việc theo cặp đôi, hoàn thành phiếu bài tập.
- GV đôn đốc và hỗ trợ HS khi cần thiết.
Bước 3. Báo cáo kết quả hoạt động và thảo luận
- Đại diện mỗi HS trả lời 1 câu trong phiếu bài tập.
- Các HS còn lại theo dõi, nhận xét (nếu có).
Bước 4. Đánh giá kết quả thực hiện nhiệm vụ
- GV tổng kết, chuẩn hoá kiến thức.
D. HOẠT ĐỘNG VẬN DỤNG
a) Mục tiêu:
- Phát triển năng lực tự học và năng lực tìm hiểu đời sống.
b) Nội dung:
- GV yêu cầu học sinh làm việc cá nhân tại nhà, hoàn thiện nhiệm vụ sau:
|
Nêu cách xác định pH của đất trồng và trình bày một số biện pháp khắc phục khi đất trồng bị chua. |
c) Sản phẩm:
- Báo cáo của HS.
d) Tổ chức thực hiện:
Bước 1. Chuyển giao nhiệm vụ học tập
- GV yêu cầu học sinh, làm việc cá nhân, tại nhà trả lời câu hỏi đã đưa ở mục b, nội dung.
- HS nhận nhiệm vụ.
Bước 2. Thực hiện nhiệm vụ học tập
- HS nghiên cứu SGK, tài liệu tham khảo hoàn thiện nhiệm vụ.
Bước 3. Báo cáo kết quả hoạt động và thảo luận
- GV yêu cầu 5 HS nộp sản phẩm vào buổi học tiếp theo.
Bước 4. Đánh giá kết quả thực hiện nhiệm vụ
- GV nhận xét, đánh giá và cho điểm đối với những bài làm tốt.
BÀI 3: ÔN TẬP CHƯƠNG 3
I. Mục tiêu
1) Kiến thức
Học xong bài này, học sinh có thể:
- Hệ thống hoá kiến thức về cân bằng hoá học, cân bằng trong dung dịch nước.
- Xác định được pH của một số dung dịch và nêu được ý nghĩa của pH.
2) Năng lực
a) Năng lực chung
- Năng lực tự chủ và tự học: Học sinh xác định đúng đắn động cơ, thái độ học tập, tự đánh giá và điều chỉnh được kế hoạch học tập; tự nhận ra được những sai sót và khắc phục.
- Năng lực giao tiếp: Tiếp thu kiến thức, trao đổi học hỏi bạn bè thông qua việc thực hiện nhiệm vụ các hoạt động cặp đôi, nhóm; có thái độ tôn trọng, lắng nghe, có phản ứng tích cực trong giao tiếp.
- Năng lực hợp tác: Học sinh xác định được nhiệm vụ của tổ/ nhóm, trách nhiệm của bản thân, đề xuất được những ý kiến đóng góp, góp phần hoàn thành nhiệm vụ học tập.
b) Năng lực chuyên biệt
- Năng lực nhận thức hóa học: hệ thống được các kiến thức về cân bằng hoá học, cân bằng trong dung dịch nước.
- Năng lực tìm hiểu thế giới tự nhiên dưới góc độ hóa học: đề xuất được các biện pháp khắc phục khi pH của một số bộ phận trong cơ thể (như dạ dày …), pH của đất trồng, nước … vượt ngoài khoảng chuẩn.
- Năng lực vận dụng kiến thức, kỹ năng đã học: hoàn thiện các bài tập trong SGK, SBT.
3) Phẩm chất
- Yêu nước: nhận biết được vẻ đẹp của tự nhiên, của đất nước thông qua bộ môn Hóa học.
- Trách nhiệm: nghiêm túc thực hiện các nhiệm vụ học tập được giao đúng tiến độ.
- Trung thực: thành thật trong việc thu thập các tài liệu và giải các bài tập.
- Chăm chỉ: tích cực trong các hoạt động cá nhân, tập thể.
- Nhân ái: quan tâm, giúp đỡ, chia sẻ những khó khăn trong việc thực hiện nhiệm vụ học tập.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
1. Giáo viên
- Thiết kế phiếu học tập, slide…
- Máy tính, máy chiếu …
2. Học sinh
- Vở ghi, SGK, SBT.
III. TIẾN TRÌNH DẠY HỌC
Hoạt động 1: Khởi động – Hệ thống hoá lí thuyết
a. Mục tiêu: Khơi gợi kiến thức cũ, tạo tâm thế hứng thú cho học sinh.
b. Nội dung:
- GV yêu cầu HS không được mở bất kì một tài liệu nào, kể cả SGK, vở ghi. Thực hiện kĩ thuật công não, hoàn thiện các phần còn khuyết trong phần hệ thống kiến thức:
HỆ THỐNG KIẾN THỨC
1. Cân bằng hoá học
|
......................................... |
Phản ứng thuận nghịch |
|
aA + bB → cC + dD Phản ứng chỉ xảy ra theo một chiều từ chất đầu tạo thành sản phẩm. |
aA + bB ........... cC + dD Trong cùng một điều kiện, phản ứng xảy ra theo ............................... |
|
Trạng thái cân bằng |
............................................................................................ |
|
Hằng số cân bằng |
Kc = ................................................................................... Chất rắn không đưa vào biểu thức tính KC. KC chỉ phụ thuộc vào ........................................................ |
|
Các yếu tố ảnh hưởng đến cân bằng hoá học |
........................................................................................... ........................................................................................... |
|
Nguyên lí chuyển dịch cân bằng Le Chatellier |
........................................................................................... ........................................................................................... |
2. Cân bằng trong dung dịch nước
|
Sự điện li Khái niệm: ............................................. Chất điện li mạnh gồm:......................... Chất điện li yếu gồm: ........................... Ví dụ 3 chất không điện li: .................. |
Thuyết acid – base của Bronsted – Lowry Acid là: .............................. Base là: ............................. |
|
Quy tắc tính pH: ........................................................................................................................................ |
|
|
Phản ứng thuỷ phân là:.................................................................................................. Ví dụ: Al3+ + H2O ....................................................................................................... |
|
c. Sản phẩm:
Câu trả lời của HS hoàn thiện phần hệ thống lí thuyết. Dự kiến:
HỆ THỐNG KIẾN THỨC
1. Cân bằng hoá học
|
Phản ứng một chiều |
Phản ứng thuận nghịch |
|
aA + bB → cC + dD Phản ứng chỉ xảy ra theo một chiều từ chất đầu tạo thành sản phẩm. |
aA + bB ⇄ cC + dD Trong cùng một điều kiện, phản ứng xảy ra theo hai chiều trái ngược nhau. |
|
Trạng thái cân bằng |
vthuận = vnghịch; nồng độ các chất trong hệ phản ứng không đổi. |
|
Hằng số cân bằng |
Kc = Chất rắn không đưa vào biểu thức tính KC. KC chỉ phụ thuộc vào bản chất của phản ứng và nhiệt độ. |
|
Các yếu tố ảnh hưởng đến cân bằng hoá học |
Nhiệt độ, nồng độ, áp suất |
|
Nguyên lí chuyển dịch cân bằng Le Chatellier |
Một phản ứng thuận nghịch đang ở trạng thái cân bằng, khi chịu một tác động bên ngoài như biến đổi nhiệt độ, nồng độ, áp suất thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó |
2. Cân bằng trong dung dịch nước
|
Sự điện li Khái niệm: Sự điện li là quá trình phân li các chất trong nước tạo thành ion. Chất điện li mạnh gồm: acid mạnh, base mạnh, hầu hết các muối. Chất điện li yếu gồm: acid yếu, base yếu. Ví dụ 3 chất không điện li: ethanol, glucose, sacharose. |
Thuyết acid – base của Bronsted – Lowry Acid là: chất cho proton. Base là: chất nhận proton. |
|
Quy tắc tính pH: pH = -log[H+] hoặc [H+] = 10-pH. |
|
|
Phản ứng thuỷ phân là: phản ứng giữa ion với nước tạo ra các dung dịch có môi trường khác nhau. Ví dụ: Al3+ + H2O ⇄ Al(OH)2+ + H+. |
|
d. Tổ chức thực hiện:
Bước 1. Chuyển giao nhiệm vụ học tập
- GV yêu cầu học sinh gấp sách vở và các tài liệu liên quan, chiếu nội dung lí thuyết còn khuyết (hoặc treo phiếu học tập) thực hiện kĩ thuật công não, yêu cầu lần lượt từng HS hoàn thiện phần điền khuyết. Mỗi HS được suy nghĩ không quá 10s để hoàn thiện phần điền khuyết của mình, quá 10s HS nhường phần trả lời cho bạn khác.
- HS nhận nhiệm vụ.
Bước 2. Thực hiện nhiệm vụ học tập
- HS thực hiện nhiệm vụ.
- GV đôn đốc.
Bước 3. Báo cáo kết quả hoạt động và thảo luận
- GV chiếu phần lí thuyết hoàn chỉnh để HS tổng hợp lại vào vở.
Bước 4. Đánh giá kết quả thực hiện nhiệm vụ
- GV nhận xét chung về tính hình nắm lí thuyết của HS và chuyển sang phần bài tập.
Hoạt động 2: Luyện tập
a) Mục tiêu:
HS vận dụng các kiến thức đã học làm được các bài tập.
b) Nội dung:
- HS làm việc theo cặp đôi, hoàn thiện các bài tập trong SGK.
c) Sản phẩm:
- Câu trả lời của HS, dự kiến:
Câu 1 trang 28 SGK Hoá học 11: Đáp án đúng là: B
Hằng số KC của một phản ứng phụ thuộc vào nhiệt độ.
Câu 2 trang 28 SGK Hoá học 11: Đáp án đúng là: D
Pha loãng dung dịch 100 lần thì nồng độ giảm 100 lần Þ pH tăng 2 đơn vị.
Câu 3 trang 28 SGK Hoá học 11:
a) NaOH → Na+ + OH-
0,1 → 0,1 M
Ta có: [H+].[OH]- = 10-14
Ta có: pH = -log[H+] = 13.
b) HCl → H+ + Cl-
0,1 → 0,1 M
Ta có: pH = -log[H+] = 1 M.
c) Ca(OH)2 → Ca2+ + 2OH-
0,01 → 0,02 M
Ta có: [H+].[OH]- = 10-14
Ta có: pH = -log[H+] = 12,3.
Câu 4 trang 28 SGK Hoá học 11:
a) 2SO2(g) + O2(g) ⇌ 2SO3 (g)
>
b) 2C(s) + O2(g) ⇌ 2CO(g)
>
c) AgCl(s) ⇌ Ag+(aq) + Cl-(aq)
KC = [Ag+].[Cl-]
Câu 5 trang 28 SGK Hoá học 11: Đáp án đúng là: C
Hằng số cân bằng chỉ phụ thuộc vào nhiệt độ và bản chất của phản ứng, không phụ thuộc vào nồng độ.
Câu 6 trang 28 SGK Hoá học 11:
- Tăng nồng độ CO, cân bằng sẽ chuyển dịch theo chiều làm giảm nồng độ CO, tức chiều thuận, chiều tăng hiệu suất phản ứng.
- ∆rHo < 0 Þ Chiều thuận toả nhiệt Þ Giảm nhiệt độ, cân bằng sẽ chuyển dịch theo chiều làm tăng nhiệt độ tức chiều thuận, chiều tăng hiệu suất phản ứng.
- Do phản ứng thuận nghịch có tổng hệ số tỉ lượng của các chất khí ở hai vế bằng nhau, việc thay đổi áp suất không làm ảnh hưởng đến cân bằng.
Câu 7 trang 28 SGK Hoá học 11:
Nồng độ ban đầu của khí CO là:
Nồng độ ban đầu của hơi nước H2O là:
CO(g) + H2O(g) ⇌ CO2(g) + H2(g)
Ban đầu: 0,1 0,1 0 0 M
Phản ứng: x x x x M
Cân bằng: (0,1 – x) (0,1 – x) x x M
Áp dụng công thức:
Þ x2 = 8,3(x2 – 0,2x + 0,01)
Þ 7,3x2 – 1,66x + 0,083 = 0
Þ x = 0,074 (thoả mãn); x = 0,153 (loại do > 0,1).
Vậy ở trạng thái cân bằng:
[CO2] = [H2] = 0,074 M.
[CO] = [H2O] = 0,026 M.
d) Tổ chức thực hiện:
Bước 1. Chuyển giao nhiệm vụ học tập
- GV yêu cầu học sinh làm việc theo cặp đôi hoàn thiện các bài tập trong SGK.
- HS nhận nhiệm vụ.
Bước 2. Thực hiện nhiệm vụ học tập
- HS làm bài tập theo cặp đôi.
- GV theo dõi, đôn đốc và hỗ trợ HS khi cần thiết.
Bước 3. Báo cáo kết quả hoạt động và thảo luận
- GV yêu cầu 7 HS lần lượt trình bày lời giải 7 bài tập (nên chọn 7 HS chưa được gọi ở phần công não lí thuyết).
- Các HS còn lại theo dõi góp ý và nhận xét nếu có.
Bước 4. Đánh giá kết quả thực hiện nhiệm vụ
- GV chuẩn hoá, chốt kiến thức và nhận xét tình hình học tập chung cả lớp.
- Giao bài về nhà cho HS, các bài tập ôn tập chương trong SBT.
................................
................................
................................
Trên đây tóm tắt một số nội dung có trong bộ Giáo án Hóa 11 Kết nối tri thức năm 2023 mới nhất, để mua tài liệu đầy đủ, Thầy/Cô vui lòng truy cập tailieugiaovien.com.vn
