Giáo án Hóa học 8 Kết nối tri thức (năm 2023 mới nhất) | Giáo án Khoa học tự nhiên 8
Haylamdo biên soạn và sưu tầm Tài liệu Giáo án Hóa học 8 Kết nối tri thức đầy đủ, chuẩn nhất theo Bộ GD giúp thầy cô dễ dàng soạn giáo án môn Khoa học tự nhiên 8 cho học sinh của mình theo chương trình mới.
Giáo án Hóa học 8 Kết nối tri thức (năm 2023 mới nhất)
Chỉ 500k mua trọn bộ Giáo án KHTN 8 Kết nối tri thức (cả năm) bản word chuẩn kiến thức, trình bày đẹp mắt, dễ dàng chỉnh sửa:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận giáo án
BÀI 1: SỬ DỤNG MỘT SỐ HOÁ CHẤT, THIẾT BỊ CƠ BẢN TRONG PHÒNG THÍ NGHIỆM
I. MỤC TIÊU
1. Năng lực
a. Năng lực khoa học tự nhiên
- Nhận thức khoa học tự nhiên: Nhận biết được một số dụng cụ hoá chất và nêu được các quy tắc sử dụng dụng cụ, hoá chất an toàn trong phòng thí nghiệm; Nhận biết được một số thiết bị đo trong môn KHTN8 và cách sử dụng điện an toàn.
- Tìm hiểu tự nhiên: Biết cách khai thác thông tin trên nhãn hoá chất để sử dụng chúng đúng cách và an toàn; Sử dụng được một số hoá chất, dụng cụ thí nghiệm, thiết bị điện trong thực tế cuộc sống và trong phòng thí nghiệm.
b. Năng lực chung
+ Tự chủ và tự học: Chủ động, tích cực tìm hiểu các phương pháp và kĩ thuật học tập môn Khoa học tự nhiên.
+ Giao tiếp và hợp tác: Hoạt động nhóm một cách hiệu quả theo đúng yêu cầu của GV đảm bảo các thành viên trong nhóm đều được tham gia và trình bày báo cáo.
+ Giải quyết vấn đề và sáng tạo: Thảo luận với các thành viên trong nhóm nhằm giải quyết các vấn đề trong bài học để hoàn thành nhiệm vụ học tập.
2. Phẩm chất
- Hứng thú, tự giác, chủ động, sáng tạo trong tiếp cận kiến thức mới qua sách vở và thực tiễn.
- Trung thực, cẩn thận trong thực hành, ghi chép kết quả thực hành, thí nghiệm.
- Có ý thức sử dụng hợp lý và bảo vệ nguồn tài sản chung.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
1. Giáo viên
- Hình ảnh một số nhãn hoá chất (hoặc hình ảnh phóng to hình 1.1); hình ảnh các thiết bị điện (có trong mục III.3 SGK KHTN8).
- Một số dụng cụ thuỷ tinh như: ống nghiệm, cốc thuỷ tinh, bình nón, phễu lọc, ống đong, ống hút nhỏ giọt, kẹp gỗ … (hoặc hình ảnh phóng to hình 1.2).
- Một số thiết bị: máy đo pH, huyết áp kế …
- Thiết kế phiếu học tập, slide, máy tính tính, máy chiếu …
2. Học sinh
- Các mẫu nước (nước máy, nước mưa, nước ao, nước chanh, nước cam, nước vôi trong … để đo pH, mỗi HS chuẩn bị 1 mẫu).
- SGK, vở ghi…
III. TIẾN TRÌNH DẠY HỌC
A. KHỞI ĐỘNG
Hoạt động 1: Mở đầu
a. Mục tiêu: Tạo tâm thế hứng thú cho học sinh và từng bước làm quen bài mới.
b. Nội dung: GV dựa vào câu hỏi mở đầu SGK – KHTN8 tr6 để dẫn dắt vào bài mới.
c. Sản phẩm: Câu trả lời của học sinh, câu trả lời có thể đúng hoặc sai, giáo viên không nhận xét tính đúng sai mà căn cứ vào đó để dẫn dắt vào bài mới.
d. Tổ chức thực hiện:
Bước 1. Chuyển giao nhiệm vụ học tập
- Giáo viên nêu nhiệm vụ: Trong chương trình KHTN chúng ta thường xuyên được thực hành làm các thí nghiệm. Vậy trong thực hành, học sinh cần chú ý những điều gì khi sử dụng các dụng cụ thí nghiệm, thiết bị đo và hoá chất để đảm bảo thành công và an toàn?
- Học sinh nhận nhiệm vụ.
Bước 2. Thực hiện nhiệm vụ học tập
- Học sinh làm việc theo cặp cùng bàn, thảo luận.
- Giáo viên theo dõi và hỗ trợ HS khi cần thiết.
Bước 3. Báo cáo kết quả hoạt động và thảo luận
- Đại diện một cặp đôi báo cáo kết quả.
- Giáo viên không nhận xét tính đúng sai mà căn cứ vào đó để dẫn dắt vào bài mới.
GV dẫn dắt vào bài: Để biết được những điều cần chú ý khi sử dụng các dụng cụ thí nghiệm, thiết bị đo và hoá chất đảm bảo thành công và an toàn chúng ta cùng tìm hiểu bài học hôm nay:
Bài 1: Sử dụng một số hoá chất, thiết bị cơ bản trong phòng thí nghiệm
B. HÌNH THÀNH KIẾN THỨC MỚI
Hoạt động 2: Tìm hiểu cách nhận biết hoá chất và quy tắc sử dụng hoá chất an toàn trong phòng thí nghiệm
a) Mục tiêu:
- Học sinh nêu được một số hoá chất và quy tắc sử dụng hoá chất an toàn trong phòng thí nghiệm.
- Học sinh khai thác được thông tin trên nhãn hoá chất để sử dụng hoá chất một cách đúng cách và an toàn.
b) Nội dung: Học sinh thảo luận theo nhóm nhỏ, hoàn thành phiếu học tập từ đó lĩnh hội kiến thức.
|
PHIẾU HỌC TẬP SỐ 1 Câu 1: Nhãn hoá chất cho biết các thông tin gì? Hãy cho biết thông tin có trên các nhãn hoá chất ở Hình 1.1? 
Câu 2: Trình bày cách lấy hoá chất rắn và hoá chất lỏng. Câu 3: Chỉ ra những tình huống nguy hiểm có thể gặp phải trong khi tiến hành thí nghiệm với hoá chất. Đề xuất cách xử lí an toàn cho mỗi tình huống đó. |
c) Sản phẩm: Câu trả lời của học sinh.
Dự kiến sản phẩm:
Câu 1: Các hoá chất trong phòng thí nghiệm đều được đựng trong chai hoặc lọ kín, thường được làm bằng thuỷ tinh, nhựa, ... và có dán nhãn ghi tên, công thức hoá học, trọng lượng hoặc thể tích, độ tinh khiết, nhà sản xuất, các kí hiệu cảnh báo, điều kiện bảo quản, ... Các dung dịch hoá chất pha sẵn có nồng độ của chất tan ...
- Nhãn a) cho biết:
+ Tên hoá chất: sodium hydroxide.
+ Công thức hoá học: NaOH.
+ Độ tinh khiết: AR – hoá chất tinh khiết.
+ Khối lượng: 500g.
+ Tiêu chuẩn chất lượng: TCCS 51/2008/HCĐG.
+ Hạn sử dụng: 3 năm kể từ ngày sản xuất.
- Nhãn b) cho biết:
+ Tên hoá chất: Hydrochloric acid.
+ Nồng độ chất tan: 37%.
+ Công thức hoá học: HCl.
+ Khối lượng mol: 36,46 g/mol.
+ Các kí hiệu cảnh báo:

- Nhãn c) cho biết:

+ Oxidizing: có tính oxi hoá.
+ Gas: thể khí.
+ Tên chất: oxygen.
+ Mã số: UN 1072 – mã số này là danh mục để xác định hoá chất nguy hiểm oxygen, nén.
+ Khối lượng: 25 kg.
Câu 2:
- Cách lấy hoá chất rắn: Không được dùng tay trực tiếp lấy hoá chất. Khi lấy hoá chất rắn ở dạng hạt nhỏ hay bột ra khỏi lọ phải dùng thìa kim loại hoặc thuỷ tinh để xúc. Lấy hoá chất rắn ở dạng hạt to, dây, thanh có thể dùng panh để gắp. Không được đặt lại thìa, panh vào các lọ đựng hoá chất sau khi đã sử dụng.
- Cách lấy hoá chất lỏng: Không được dùng tay trực tiếp lấy hoá chất. Lấy hoá chất lỏng từ chai miệng nhỏ thường phải rót qua phễu hoặc qua cốc, ống đong có mỏ, lấy lượng nhỏ dung dịch thường dùng ống hút nhỏ giọt; rót hoá chất lỏng từ lọ cần hướng nhãn hoá chất lên phía trên tránh để các giọt hoá chất dính vào nhãn làm hỏng nhãn.
Câu 3:
- Những tình huống nguy hiểm có thể gặp phải trong khi tiến hành thí nghiệm với hoá chất và cách xử lí:
+ Nếu bị bỏng vì acid đặc, nhất là sulfuric acid đặc thì phải dội nước rửa ngay nhiều lần, nếu có vòi nước thì cho chảy mạnh vào vết bỏng 3 – 5 phút, sau đó rửa bằng dung dịch NaHCO3, không được rửa bằng xà phòng.
+ Bị bỏng vì kiềm đặc thì lúc đầu chữa như bị bỏng acid, sau đó rửa bằng dung dịch loãng acetic acid 5% hay giấm.
+ Khi bị ngộ độc bởi các khí độc, cần đình chỉ thí nghiệm, mở ngay cửa và cửa sổ, đưa ngay bệnh nhân ra ngoài chỗ thoáng gió, đưa các bình có chứa hoặc sinh ra khí độc vào tủ hốt hoặc đưa ra ngoài phòng…
d) Tổ chức thực hiện:
|
HOẠT ĐỘNG CỦA GV VÀ HS |
NỘI DUNG |
|
Bước 1. Chuyển giao nhiệm vụ học tập - Giáo viên yêu cầu học sinh làm việc theo nhóm nhỏ (theo bàn) thảo luận và hoàn thiện phiếu học tập số 1. - HS nhận nhiệm vụ. Bước 2. Thực hiện nhiệm vụ học tập - HS nghiên cứu tài liệu, thảo luận nhóm, hoàn thiện phiếu học tập số 1. - GV theo dõi, đôn đốc và hỗ trợ học sinh khi cần thiết. Bước 3. Báo cáo kết quả hoạt động và thảo luận - Đại diện 3 nhóm lần lượt trình bày đáp án từng câu hỏi, các nhóm khác theo dõi, nhận xét, bổ sung. Bước 4. Đánh giá kết quả thực hiện nhiệm vụ - GV tổng kết, chuẩn hoá kiến thức. |
I. Nhận biết hoá chất và quy tắc sử dụng hoá chất an toàn trong phòng thí nghiệm 1. Nhận biết hoá chất Các hoá chất trong phòng thí nghiệm đều được đựng trong chai hoặc lọ kín, thường được làm bằng thuỷ tinh, nhựa, ... và có dán nhãn ghi tên, công thức hoá học, trọng lượng hoặc thể tích, độ tinh khiết, nhà sản xuất, các kí hiệu cảnh báo, điều kiện bảo quản, ... Các dung dịch hoá chất pha sẵn có nồng độ của chất tan ... 2. Quy tắc sử dụng hoá chất an toàn trong phòng thí nghiệm - Không sử dụng hoá chất đựng trong đồ chứa không có nhãn hoặc nhãn mờ, mất chữ. Đọc cẩn thận nhãn hoá chất, tìm hiểu kĩ tính chất, cảnh báo … của mỗi loại hoá chất trước khi sử dụng. - Thực hiện thí nghiệm cẩn thận, đúng quy tắc, không dùng tay trực tiếp lấy hoá chất. - Khi bị hoá chất dính vào người hoặc hoá chất bị đổ, bị tràn cần báo cáo với giáo viên để được hướng dẫn xử lí. - Các hoá chất dùng xong còn thừa, không được đổ trở lại bình chứa mà cần được xử lí theo hướng dẫn của giáo viên. |
Hoạt động 3: Tìm hiểu một số dụng cụ thí nghiệm và cách sử dụng
a) Mục tiêu: Học sinh nêu được một số dụng cụ thí nghiệm thông dụng (ống nghiệm, cốc thuỷ tinh, bình nón, phễu lọc, ống đong, ống hút, ống nhỏ giọt, kẹp gỗ …) và cách sử dụng một số dụng cụ thí nghiệm này.
b) Nội dung:
Học sinh thảo luận theo nhóm nhỏ, hoàn thành phiếu học tập số 2, từ đó lĩnh hội kiến thức.
|
PHIẾU HỌC TẬP SỐ 2 Câu 1: Tìm dụng cụ cần thiết trong cột B phù hợp với mục đích sử dụng trong cột A. 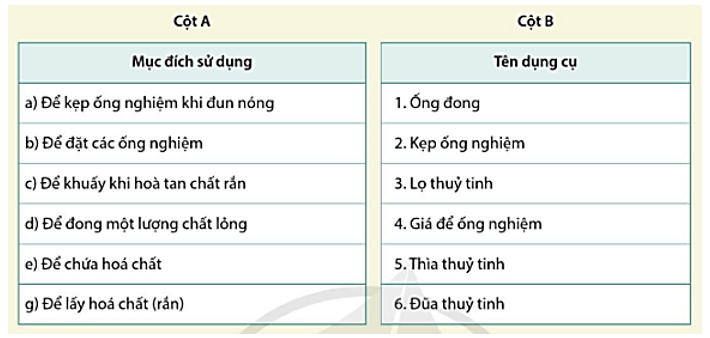
Câu 2: Khi đun nóng hoá chất trong ống nghiệm, không nên kẹp ống nghiệm quá cao hoặc quá thấp và phải hơ nóng đều ống nghiệm. Hãy giải thích điều này. Câu 3: Nêu cách sử dụng ống hút nhỏ giọt khi làm thí nghiệm. |
c) Sản phẩm: Câu trả lời của học sinh.
Dự kiến sản phẩm:
Câu 1:
a – 2; b – 4; c – 6; d – 1; e – 3; g - 5.
Câu 2:
- Khi kẹp ống nghiệm, cần kẹp ở vị trí 1/3 ống nghiệm, tính từ miệng ống nghiệm xuống.
Không nên kẹp ống nghiệm quá cao để dễ dàng thao tác thí nghiệm; không nên kẹp ống nghiệm quá thấp tránh để tuột, rơi ống nghiệm, đặc biệt là ống nghiệm đã chứa hoá chất, gây nguy hiểm.
- Khi đun hoá chất cần phải hơ nóng đều ống nghiệm, sau đó mới đun trực tiếp tại nơi có hoá chất. Việc hơ nóng đều ống nghiệm giúp nhiệt toả đều, tránh làm nứt, vỡ ống nghiệm khi lửa tụ nhiệt tại một điểm.
Câu 3: Cách sử dụng ống hút nhỏ giọt khi làm thí nghiệm: Ống hút nhỏ giọt thường có quả bóp cao su để lấy chất lỏng với lượng nhỏ. Khi lấy chất lỏng, bóp chặt và giữ quả bóp cao su, đưa ống hút nhỏ giọt vào lọ đựng hoá chất, thả chậm quả bóng cao su để hút chất lỏng lên. Chuyển ống hút nhỏ giọt đến ống nghiệm và bóp nhẹ quả bóp cao su để chuyển từng giọt dung dịch vào ống nghiệm. Không chạm đầu ống hút nhỏ giọt vào thành ống nghiệm.
d) Tổ chức thực hiện:
|
HOẠT ĐỘNG CỦA GV VÀ HS |
NỘI DUNG |
|
Bước 1. Chuyển giao nhiệm vụ học tập - Giáo viên yêu cầu học sinh làm việc theo nhóm nhỏ (theo bàn) thảo luận và hoàn thiện phiếu học tập số 2. - HS nhận nhiệm vụ. Bước 2. Thực hiện nhiệm vụ học tập - HS nghiên cứu tài liệu, thảo luận nhóm, hoàn thiện phiếu học tập số 2. - GV theo dõi, đôn đốc và hỗ trợ học sinh khi cần thiết. Bước 3. Báo cáo kết quả hoạt động và thảo luận - Đại diện 3 nhóm lần lượt trình bày đáp án từng câu hỏi, các nhóm khác theo dõi, nhận xét, bổ sung. Bước 4. Đánh giá kết quả thực hiện nhiệm vụ - GV tổng kết, chuẩn hoá kiến thức. |
II. Giới thiệu một số dụng cụ thí nghiệm và cách sử dụng 1. Một số dụng cụ thí nghiệm thông dụng Ống nghiệm, cốc thuỷ tinh, bình nón, phễu lọc, ống đong, ống hút nhỏ giọt, kẹp gỗ… 2. Cách sử dụng một số dụng cụ thí nghiệm a) Ống nghiệm - Khi thực hiện thí nghiệm, giữ ống nghiệm bằng tay không thuận, dùng tay thuận để thêm hoá chất vào ống nghiệm. - Khi đun nóng hoá chất trong ống nghiệm cần kẹp ống nghiệm bằng kẹp ở khoảng 1/3 ống nghiệm tính từ miệng ống. Từ từ đưa đáy ống nghiệm vào ngọn lửa đèn cồn, miệng ống nghiêng về phía không có người, làm nóng đều đáy ống nghiệm rồi mới đun trực tiếp tại nơi có hoá chất. Điều chỉnh đáy ống nghiệm vào vị trí nóng nhất của ngọn lửa (khoảng 2/3 ngọn lửa từ dưới lên), không để đáy ống nghiệm chạm vào bấc đèn cồn. b) Ống hút nhỏ giọt Ống hút nhỏ giọt thường có quả bóp cao su để lấy chất lỏng với lượng nhỏ. Khi lấy chất lỏng, bóp chặt và giữ quả bóp cao su, đưa ống hút nhỏ giọt vào lọ đựng hoá chất, thả chậm quả bóng cao su để hút chất lỏng lên. Chuyển ống hút nhỏ giọt đến ống nghiệm và bóp nhẹ quả bóp cao su để chuyển từng giọt dung dịch vào ống nghiệm. Không chạm đầu ống hút nhỏ giọt vào thành ống nghiệm. |
Hoạt động 4: Tìm hiểu về thiết bị đo pH
a) Mục tiêu:
- Học sinh nắm được cách sử dụng thiết bị đo pH.
- Học sinh thực hiện đo và đọc kết quả pH của một số dung dịch.
b) Nội dung: Học sinh làm việc theo nhóm, nghiên cứu SGK và thực hiện hoạt động – SGK tr8, hoàn thành phiếu học tập số 3, từ đó lĩnh hội kiến thức.
|
PHIẾU HỌC TẬP SỐ 3 Câu 1: Nêu cách sử dụng thiết bị đo pH. Câu 2: Sử dụng thiết bị đo pH để xác định pH của các mẫu sau: a) nước máy; b) nước mưa; c) nước hồ/ ao; d) nước chanh; e) nước cam; g) nước vôi trong. |
c) Sản phẩm: Câu trả lời của học sinh.
Dự kiến:
Câu 1: Cách sử dụng thiết bị đo pH: cho điện cực của thiết bị vào dung dịch cần đo pH, giá trị pH của dung dịch sẽ xuất hiện trên thiết bị đo.
Câu 2: Kết quả tham khảo:
|
Mẫu |
pH |
|
a) nước máy |
7,5 |
|
b) nước mưa |
6,5 |
|
c) nước hồ/ ao |
7,6 |
|
d) nước chanh |
2,4 |
|
e) nước cam |
3,5 |
|
g) nước vôi trong |
12 |
d) Tổ chức thực hiện:
|
HOẠT ĐỘNG CỦA GV VÀ HS |
NỘI DUNG |
|
Bước 1. Chuyển giao nhiệm vụ học tập - GV chiếu hình ảnh máy đo pH phân tích cấu tạo máy đo pH và cách sử dụng. - GV giao mỗi nhóm 1 bút đo pH, yêu cầu HS quan sát. Sau đó GV làm mẫu đo pH của 1 dung dịch bất kì bằng bút đo pH. - GV yêu cầu HS làm việc theo nhóm hoàn thiện phiếu học tập số 3. - HS nhận nhiệm vụ. Bước 2. Thực hiện nhiệm vụ học tập - Học sinh thảo luận nhóm hoàn thiện câu hỏi 1 sau đó thực hành theo nhóm xác định pH của các dung dịch và ghi lại kết quả. - GV quan sát, đôn đốc và hỗ trợ học sinh khi cần thiết. Bước 3. Báo cáo kết quả - Đại diện từng nhóm HS báo cáo kết quả, các nhóm khác theo dõi nhận xét. Bước 4. Đánh giá kết quả thực hiện nhiệm vụ - GV tổng kết, chuẩn hoá kiến thức. |
III. Giới thiệu một số thiết bị và cách sử dụng 1. Thiết bị đo pH Cách sử dụng thiết bị đo pH: cho điện cực của thiết bị vào dung dịch cần đo pH, giá trị pH của dung dịch sẽ xuất hiện trên thiết bị đo. |
Hoạt động 5: Tìm hiểu về huyết áp kế
a) Mục tiêu: Học sinh nắm được cấu tạo của huyết áp kế đồng hồ, biết cách sử dụng huyết áp kế đồng hồ để đo huyết áp.
b) Nội dung:
- HS tìm hiểu SGK và quan sát thực tế huyết áp kế đồng hồ nêu được cấu tạo và cách sử dụng huyết áp kế đồng hồ.
- HS thực hành đo huyết áp của bạn cùng bàn bằng huyết áp kế đồng hồ.
c) Sản phẩm:
- Cấu tạo huyết áp kế đồng hồ: gồm một bao làm bằng cao su, được bọc trong băng vải dài để có thể quấn quanh cánh tay, nối với áp kế đồng hồ bằng đoạn ống cao su. Áp kế này lại được nối với bóp cao su có van và một ốc có thể vặn chặt hoặc nới lỏng.
- Kết quả đo huyết áp của bạn bên cạnh.
d) Tổ chức thực hiện:
|
HOẠT ĐỘNG CỦA GV VÀ HS |
NỘI DUNG |
|
Bước 1. Chuyển giao nhiệm vụ học tập - GV giới thiệu huyết áp kế đồng hồ, yêu cầu HS nêu cấu tạo của huyết áp kế đồng hồ. - GV tiến hành đo huyết áp của một bạn HS để làm mẫu. Sau đó yêu cầu HS thực hành đo huyết áp của bạn bên cạnh, ghi lại kết quả. - HS nhận nhiệm vụ. Bước 2. Thực hiện nhiệm vụ học tập - HS thực hiện nhiệm vụ. - GV đôn đốc, theo dõi và hỗ trợ học sinh khi cần thiết. Bước 3. Báo cáo kết quả - Một số HS đại diện báo cáo kết quả đo huyết áp của bạn bên cạnh. Bước 4. Đánh giá kết quả thực hiện nhiệm vụ - GV tổng kết và có thể mở rộng thêm kiến thức về chỉ số huyết áp đến sức khoẻ con người. |
2. Huyết áp kế - Huyết áp kế dùng để đo huyết áp gồm huyết áp kế đồng hồ và huyết áp kế thuỷ ngân…. - Cấu tạo huyết áp kế đồng hồ: gồm một bao làm bằng cao su, được bọc trong băng vải dài để có thể quấn quanh cánh tay, nối với áp kế đồng hồ bằng đoạn ống cao su. Áp kế này lại được nối với bóp cao su có van và một ốc có thể vặn chặt hoặc nới lỏng.
|
Hoạt động 6: Tìm hiểu thiết bị điện và cách sử dụng
a) Mục tiêu: Học sinh nêu được 1 số thiết bị điện và cách sử dụng các thiết bị này.
b) Nội dung: Học sinh nghiên cứu SGK, thảo luận theo nhóm hoàn thành phiếu học tập số 4, từ đó lĩnh hội kiến thức:
|
PHIẾU HỌC TẬP SỐ 4 Câu 1: Trong gia đình cũng có một số thiết bị điện cơ bản, kể tên những thiết bị đó? Câu 2: Kể và mô tả về một số loại pin mà em biết. Câu 3: Quan sát ampe kế, vôn kế trong Hình 1.6: 
a. Chỉ ra các điểm đặc trưng của ampe kế và vôn kế. b. Chỉ ra sự khác nhau giữa hai dụng cụ này. Câu 4: Hãy thảo luận nhóm về cách sử dụng điện an toàn trong phòng thí nghiệm: - Khi sử dụng thiết bị đo điện (ampe kế, vôn kế, joulemeter, …) cần lưu ý điều gì để đảm bảo an toàn cho thiết bị và người sử dụng? - Khi sử dụng nguồn điện và biến áp nguồn cần lưu ý điều gì? - Trình bày cách sử dụng an toàn các thiết bị điện. |
c) Sản phẩm: Câu trả lời của học sinh. Dự kiến:
Câu 1:
- Điện trở, biến trở thường có trong các thiết bị sử dụng điện: quạt điện, bếp điện, ti vi, …
- Pin thường có trong các thiết bị điều khiển, đồ chơi trẻ em.
- Công tắc, cầu chì, aptômát thường mắc trong mạch điện để bảo vệ các thiết bị sử dụng điện.
- Ổ cắm điện, dây nối là các thiết bị điện hỗ trợ khi lắp mạch điện.
Câu 2:
- Pin tiểu (Pin 2A/ pin con thỏ, pin 3A) thường dùng trong các thiết bị điện tử cẩm tay như đồng hồ treo tường, điều khiển, đồ chơi trẻ em, …
- Pin trung (pin C) có hình trụ tròn, có kích thước 50 × 26mm, có dung lượng trung bình là khoảng 6000mAh và được sử dụng linh hoạt trong các thiết bị thông dụng như mồi lửa bếp ga, đài cát – sét, …
- Pin đại (pin D, pin LR20) là loại pin có dung lượng lớn nhất trong các loại pin hình trụ, với dung lượng tối đa lên tới 12.000 mAh, kích thước là 60 × 34 mm. Thường được sử dụng trong các mẫu đèn pin cỡ lớn.
- Pin cúc áo (pin điện tử) là loại pin dẹt, có kích thước rất nhỏ với đường kính khoảng 20mm, chiều cao khoảng 2,9 mm đến 3,2 mm tùy thuộc vào kiểu máy và có dung lượng từ 110mAh đến 150mAh. Thường được dùng làm nguồn điện cho các thiết bị, đồ dùng, vật dụng nhỏ như đồng hồ, đồ chơi.
Câu 3:
a. Các điểm đặc trưng của ampe kế và vôn kế.
- Các điểm đặc trưng của ampe kế:
+ Trên màn hình của ampe kế có chữ A hoặc mA.
+ Có các chốt được ghi dấu (+) với chốt dương và dấu (–) với chốt âm.
+ Có nút điều chỉnh kim để có thể đưa ampe kế về chỉ số 0.
- Các điểm đặc trưng của vôn kế:
+ Trên màn hình của ampe kế có chữ V hoặc mV.
+ Có các chốt được ghi dấu (+) với chốt dương và dấu (–) với chốt âm.
+ Có nút điều chỉnh kim để có thể đưa vôn kế về chỉ số 0.
b. Sự khác nhau giữa hai dụng cụ ampe kế và vôn kế.
|
So sánh |
Ampe kế |
Vôn kế |
|
Chức năng |
Là dụng cụ đo cường độ dòng điện. |
Là dụng cụ đo hiệu điện thế. |
|
Cách mắc |
Mắc nối tiếp với thiết bị điện: Cực (+) của ampe kế mắc với cực (+) của nguồn điện, cực (-) của ampe kế mắc với cực (+) của thiết bị điện, cực (-) của thiết bị điện mắc với cực (-) của nguồn điện. |
Mắc song song với thiết bị điện để đo hiệu điện thế của thiết bị. Mắc song song với nguồn điện để đo hiệu điện thế của nguồn. Cụ thể: cực (+) của vôn kế nối với cực (+) của nguồn điện/thiết bị điện, cực (-) của vôn kế nối với cực (-) của nguồn điện/thiết bị điện. |
|
Điện trở |
Ampe kế có điện trở không đáng kể. |
Vôn kế có điện trở vô cùng lớn. |
Câu 4:
- Để đảm bảo an toàn cho thiết bị và người sử dụng khi sử dụng thiết bị đo điện (ampe kế, vôn kế, joulemeter, …) ta cần lưu ý:
+ Sử dụng đúng chức năng, đúng thang đo của thiết bị đo điện.
+ Mắc vào mạch điện đúng cách.
+ Sử dụng nguồn điện phù hợp với thiết bị đo điện.
- Khi sử dụng nguồn điện và biến áp nguồn cần lưu ý:
+ Chọn đúng điện áp.
+ Chọn đúng chức năng.
+ Mắc đúng các chốt cắm.
- Cách sử dụng an toàn các thiết bị điện:
+ Lắp đặt thiết bị đóng ngắt điện, thiết bị điện hỗ trợ đúng cách, phù hợp.
+ Giữ khoảng cách an toàn với nguồn điện trong gia đình.
+ Tránh xa nơi điện thế nguy hiểm.
+ Tránh sử dụng thiết bị điện khi đang sạc.
d) Tổ chức thực hiện:
|
HOẠT ĐỘNG CỦA GV VÀ HS |
NỘI DUNG |
|
Bước 1. Chuyển giao nhiệm vụ học tập - Giáo viên yêu cầu học sinh làm việc theo nhóm nhỏ (theo bàn) thảo luận và hoàn thiện phiếu học tập số 4. - HS nhận nhiệm vụ. Bước 2. Thực hiện nhiệm vụ học tập - HS nghiên cứu tài liệu, thảo luận nhóm, hoàn thiện phiếu học tập số 4. - GV theo dõi, đôn đốc và hỗ trợ học sinh khi cần thiết. Bước 3. Báo cáo kết quả hoạt động và thảo luận - Đại diện 4 nhóm lần lượt trình bày đáp án từng câu hỏi, các nhóm khác theo dõi, nhận xét, bổ sung. Bước 4. Đánh giá kết quả thực hiện nhiệm vụ - GV tổng kết, chuẩn hoá kiến thức. |
3. Thiết bị điện và cách sử dụng a) Thiết bị cung cấp điện (nguồn điện) Các thí nghiệm thường dùng nguồn điện là pin 1,5 V. Để có bộ nguồn 3 V thì dùng hai pin, để có bộ nguồn 6 V thì dùng 4 pin. b) Biến áp nguồn Biến áp nguồn là thiết bị có chức năng chuyển đổi điện áp xoay chiều có giá trị 220 V thành điện áp xoay chiều hoặc điện áp một chiều có giá trị nhỏ đảm bảo an toàn khi tiến hành thí nghiệm. c) Thiết bị đo điện Thiết bị đo điện gồm ampe kế và vôn kế: ampe kế đo cường độ dòng điện, vôn kế đo hiệu điện thế. d) Joulemeter Joulemeter là thiết bị có chức năng dùng để đo dòng điện, điện áp, công suất và năng lượng điện cung cấp cho mạch điện. Các giá trị này được hiển thị trên màn hình LED. e) Thiết bị sử dụng điện Một số thiết bị sử dụng điện trong phòng thí nghiệm: - Biến trở; - Điôt phát quang (kèm điện trở bảo vệ) - Bóng đèn kèm đui 3 V g) Thiết bị điện hỗ trợ Một số thiết bị điện hỗ trợ trong phòng thí nghiệm: - Công tắc; - Cầu chì ống; - Dây nối… |
C. LUYỆN TẬP
a) Mục tiêu:
- Hệ thống được một số kiến thức đã học.
b) Nội dung:
- GV yêu cầu học sinh làm việc theo cặp đôi, hoàn thiện phiếu học tập số 5:
PHIẾU HỌC TẬP SỐ 5
Câu 1: Kí hiệu cảnh báo dưới đây được in trên nhãn chai hoá chất. Kí hiệu này có nghĩa là

A. hoá chất dễ cháy.
B. hoá chất độc với môi trường.
C. hoá chất kích ứng đường hô hấp.
D. hoá chất gây hại cho sức khoẻ.
Câu 2: Việc làm nào sau đây không đảm bảo quy tắc an toàn trong phòng thí nghiệm?
A. Không sử dụng hoá chất đựng trong đồ chứa không có nhãn hoặc nhãn mờ.
B. Đọc cẩn thận nhãn hoá chất trước khi sử dụng.
C. Có thể dùng tay trực tiếp lấy hoá chất.
D. Không được đặt lại thìa, panh vào lọ đựng hoá chất sau khi đã sử dụng.
Câu 3: Để lấy một lượng nhỏ dung dịch (khoảng 1 mL) thường dùng dụng cụ nào sau đây?
A. Phễu lọc.
B. Ống đong có mỏ.
C. Ống nghiệm.
D. Ống hút nhỏ giọt.
Câu 4: Khi đun nóng hoá chất trong ống nghiệm, cách làm nào sau đây là sai?
A. Kẹp ống nghiệm bằng kẹp ở khoảng 1/3 ống nghiệm tính từ miệng ống.
B. Miệng ống nghiệm nghiêng về phía không có người.
C. Làm nóng đều đáy ống nghiệm rồi mới đun trực tiếp tại nơi có hoá chất.
D. Để đáy ống nghiệm sát vào bấc đèn cồn.
Câu 5: Mẫu nước nào sau đây có pH > 7?
A. Nước cam.
B. Nước vôi trong.
C. Nước chanh.
D. Nước coca cola.
Câu 6: Thiết bị cung cấp điện là
A. pin 1,5 V.
B. ampe kế.
C. vôn kế.
D. công tắc.
Câu 7: Thiết bị đo cường độ dòng điện là
A. vôn kế.
B. ampe kế.
C. biến trở.
D. cầu chì ống.
Câu 8: Biến áp nguồn là thiết bị có chức năng
A. đo cường độ dòng điện.
B. đo hiệu điện thế.
C. chuyển đổi điện áp xoay chiều có giá trị 220V thành điện áp xoay chiều hoặc điện áp một chiều có giá trị nhỏ.
D. đo dòng điện, điện áp, công suất và năng lượng điện cung cấp cho mạch điện.
Câu 9: Thiết bị sử dụng điện là
A. điốt phát quang (kèm điện trở bảo vệ).
B. dây nối.
C. công tắc.
D. cầu chì.
Câu 10: Thiết bị có chức năng dùng để đo dòng điện, điện áp, công suất và năng lượng điện cung cấp cho mạch điện là
A. biến trở.
B. joulemeter.
C. cầu chì.
D. biến áp nguồn.
c) Sản phẩm:
Câu trả lời của học sinh. Đáp án
|
Câu 1 |
Câu 2 |
Câu 3 |
Câu 4 |
Câu 5 |
Câu 6 |
Câu 7 |
Câu 8 |
Câu 9 |
Câu 10 |
|
A |
C |
D |
D |
B |
A |
B |
C |
A |
B |
d) Tổ chức thực hiện:
Bước 1: Chuyển giao nhiệm vụ học tập
- GV phát phiếu học tập số 5, yêu cầu học sinh thảo luận theo cặp đôi trong 15 phút, hoàn thành phiếu học tập.
- HS nhận nhiệm vụ.
Bước 2: Thực hiện nhiệm vụ học tập
- Học sinh thảo luận theo cặp đôi.
- GV đôn đốc và hỗ trợ khi cần thiết.
Bước 3: Báo cáo kết quả và thảo luận
- Lần lượt đại diện từng nhóm báo cáo kết quả, mỗi bạn báo cáo 1 câu, không trùng lặp.
- Các nhóm còn lại theo dõi, nhận xét, góp ý (nếu có)
Bước 4: Đánh giá kết quả thực hiện nhiệm vụ
- GV nhận xét, chuẩn hoá kiến thức.
D. VẬN DỤNG
a) Mục tiêu:
- Phát triển năng lực tự học, tự tìm hiểu của học sinh.
b) Nội dung:
- Học sinh làm việc ở nhà: Sưu tầm hình ảnh 1 số nhãn dán hoá chất (trên sách, báo, internet …) và khai thác các thông tin trên nhãn hoá chất để sử dụng hoá chất đúng cách, an toàn.
c) Sản phẩm:
- Báo cáo của học sinh.
d) Tổ chức thực hiện:
Bước 1: Chuyển giao nhiệm vụ học tập
- Giáo viên yêu cầu học sinh về nhà: Sưu tầm hình ảnh 1 số nhãn dán hoá chất (trên sách, báo, internet …) và khai thác các thông tin trên nhãn hoá chất để sử dụng hoá chất đúng cách, an toàn. Học sinh nộp sản phẩm vào buổi học sau.
- HS nhận nhiệm vụ.
Bước 2: Thực hiện nhiệm vụ học tập
- HS thực hiện tại nhà.
Bước 3: Báo cáo kết quả và thảo luận
- HS nộp báo cáo sản phẩm vào buổi học sau.
Bước 4: Đánh giá kết quả thực hiện nhiệm vụ
- GV nhận xét, đánh giá và có thể cho điểm với những bài làm tốt.
BÀI 2: PHẢN ỨNG HOÁ HỌC
I. MỤC TIÊU
1. Năng lực
a. Năng lực khoa học tự nhiên
+ Nêu được khái niệm, đưa ra được ví dụ minh hoạ và phân biệt được biến đổi vật lí, biến đổi hoá học.
+ Tiến hành được một số thí nghiệm về biến đổi vật lí và biến đổi hoá học.
+ Nêu được khái niệm phản ứng hoá học, chất đầu, sản phẩm và sự sắp xếp khác nhau của các nguyên tử trong phân tử các chất.
+ Chỉ ra được một số dấu hiệu chứng tỏ có phản ứng hoá học xảy ra.
+ Nêu được khái niệm, đưa ra được ví dụ minh hoạ về phản ứng toả nhiệt, thu nhiệt và trình bày được các ứng dụng phổ biến của phản ứng toả nhiệt (đốt cháy than, xăng, dầu).
b. Năng lực chung
+ Tự chủ và tự học: Chủ động, tích cực nghiên cứu SGK, tài liệu tham khảo …
+ Giao tiếp và hợp tác: Hoạt động nhóm một cách hiệu quả theo đúng yêu cầu của GV đảm bảo các thành viên trong nhóm đều được tham gia và trình bày báo cáo.
+ Giải quyết vấn đề và sáng tạo: Thảo luận với các thành viên trong nhóm nhằm giải quyết các vấn đề trong bài học để hoàn thành nhiệm vụ học tập.
2. Phẩm chất
- Hứng thú, tự giác, chủ động, sáng tạo trong tiếp cận kiến thức mới qua sách vở và thực tiễn.
- Trung thực, cẩn thận trong thực hành, ghi chép kết quả thực hành, thí nghiệm.
- Có ý thức sử dụng hợp lý và bảo vệ nguồn tài sản chung.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
1. Giáo viên
- 6 bộ dụng cụ cho 6 nhóm:
+ Hoá chất: nước đá viên, dung dịch: HCl, NaOH, CuSO4, BaCl2, Zn.
+ Dụng cụ: cốc thuỷ tinh (dung tích 250 mL), nhiệt kế, đèn cồn, kiềng sắt, giá để ống nghiệm, ống nghiệm, ống hút nhỏ giọt.
- Video thí nghiệm sắt phản ứng với lưu huỳnh (nếu không có video tương tự như các bước tiến hành trong SGK thì GV có thể tự làm thí nghiệm tại phòng thí nghiệm sau đó quy video lại hoặc GV biểu diễn thí nghiệm trên lớp).
- Thiết kế phiếu học tập, slide.
- Máy tính, máy chiếu …
2. Học sinh
- SGK, vở ghi …
III. TIẾN TRÌNH DẠY HỌC
A. KHỞI ĐỘNG
Hoạt động 1: Mở đầu
a. Mục tiêu: Khơi gợi kiến thức cũ, tạo tâm thế hứng thú cho học sinh và từng bước làm quen bài mới.
b. Nội dung: HS thảo luận theo cặp đôi, trả lời câu hỏi mở đầu trang 11 - SGK – KHTN8 từ đó hình thành mục tiêu bài học.
|
CÂU HỎI MỞ ĐẦU Khi đốt nến, một phần nến chảy lỏng, một phần nến bị cháy. Cây nến ngắn dần. Vậy phần nến nào đã bị biến đổi thành chất mới? |
c. Sản phẩm:
Câu trả lời của học sinh. Dự kiến:
Phần nến bị cháy đã bị biến đổi thành chất mới. Cụ thể nến cháy sinh ra carbon dioxide và nước.
d. Tổ chức thực hiện:
Bước 1. Chuyển giao nhiệm vụ học tập
- GV nêu vấn đề: Trong chương trình KHTN6 các em đã được biết thế nào là hiện tượng vật lí, thế nào là hiện tượng hoá học. Vậy khi đốt nến, một phần nến chảy lỏng, một phần nến bị cháy. Cây nến ngắn dần. Vậy phần nến nào đã bị biến đổi thành chất mới? Các em hãy thảo luận cùng bạn bên cạnh để trả lời câu hỏi này.
- HS nhận nhiệm vụ.
Bước 2. Thực hiện nhiệm vụ học tập
- HS thảo luận cặp đôi.
- GV quan sát, đôn đốc và hỗ trợ HS khi cần thiết.
Bước 3. Báo cáo kết quả hoạt động và thảo luận
- Đại diện học sinh trình bày câu trả lời, các HS còn lại theo dõi nhận xét.
Bước 4: Đánh giá kết quả thực hiện nhiệm vụ
- GV chuẩn hoá kiến thức và dẫn dắt vào bài mới.
GV dẫn dắt vào bài: Để củng cố kiến thức về biến đổi vật lí, biến đổi hoá học và đào sâu kiến thức về biến đổi hoá học các em cùng cô tìm hiểu bài học hôm nay:
Bài 2: Phản ứng hoá học
B. HÌNH THÀNH KIẾN THỨC MỚI
Hoạt động 2: Tìm hiểu về biến đổi vật lí và biến đổi hoá học
a) Mục tiêu:
- Nêu được khái niệm, đưa ra được ví dụ minh hoạ và phân biệt được biến đổi vật lí, biến đổi hoá học.
- Tiến hành được một số thí nghiệm về biến đổi vật lí, biến đổi hoá học.
- Quan sát thí nghiệm hoặc hiện tượng thực tiễn xác định được giai đoạn biến đổi vật lí, giai đoạn biến đổi hoá học.
b) Nội dung:
- Học sinh làm việc nhóm, làm thí nghiệm (hoặc quan sát thí nghiệm), hoàn thành phiếu học tập, từ đó lĩnh hội kiến thức.
|
PHIẾU HỌC TẬP SỐ 1 Thí nghiệm 1: Thí nghiệm về biến đổi vật lí Thực hiện thí nghiệm như hình vẽ: 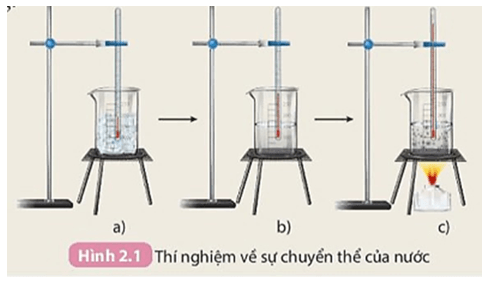
Quan sát hiện tượng và trả lời các câu hỏi sau: 1. Xác định các giá trị nhiệt độ tương ứng với các bước thí nghiệm mô tả trong Hình 2.1. 2. Ở quá trình ngược lại, hơi nước ngưng tụ thành nước lỏng, nước lỏng đông đặc thành nước đá. Vậy trong quá trình chuyển thể, nước có biến đổi thành chất khác không? Thí nghiệm 2: Thí nghiệm về biến đổi hoá học Quan sát video thí nghiệm và trả lời các câu hỏi sau: 1. Sau khi trộn bột sắt và bột lưu huỳnh, hỗn hợp thu được có bị nam châm hút không? 2. Chất trong ống nghiệm (2) sau khi đun nóng và để nguội có bị nam châm hút không? 3. Sau khi trộn bột sắt và bột lưu huỳnh, có chất mới được tạo thành không? Giải thích. 4. Sau khi đun nóng hỗn hợp bột sắt và bột lưu huỳnh, có chất mới được tạo thành không? Giải thích. |
c) Sản phẩm:
- Câu trả lời của HS, dự kiến:
Thí nghiệm 1: Thí nghiệm về biến đổi vật lí
1. Kết quả được thể hiện ở bảng sau:
|
Bước |
a |
b |
c |
|
Nhiệt độ |
0 oC |
5 oC |
100 oC |
2. Trong quá trình chuyển thể, nước chỉ bị thay đổi trạng thái, không bị biến đổi thành chất khác.
Thí nghiệm 2: Thí nghiệm về biến đổi hoá học
1. Sau khi trộn bột sắt và bột lưu huỳnh, đưa nam châm lại gần ống nghiệm (1) thấy nam châm hút, suy ra hỗn hợp thu được có bị nam châm hút.
2. Chất trong ống nghiệm (2) sau khi đun nóng và để nguội không bị nam châm hút.
3. Sau khi trộn bột sắt và bột lưu huỳnh không có chất mới tạo thành, do đây chỉ là sự trộn vật lí, không có sự thay đổi về chất và lượng, sắt trong hỗn hợp vẫn bị nam châm hút.
4. Sau khi đun nóng hỗn hợp bột sắt và bột lưu huỳnh, có chất mới được tạo thành. Do đã có phản ứng hoá học xảy ra, sinh ra chất mới không bị nam châm hút.
d) Tổ chức thực hiện:
|
HOẠT ĐỘNG CỦA GV VÀ HS |
NỘI DUNG |
|
Nhiệm vụ 1: Tìm hiểu về biến đổi vật lí Bước 1. Chuyển giao nhiệm vụ học tập - GV chia lớp thành 6 nhóm, yêu cầu các nhóm nghiên cứu SGK tìm hiểu cách tiến hành thí nghiệm 1. Sau đó các nhóm tiến hành làm thí nghiệm 1, thảo luận và trả lời các câu hỏi 1, 2 (thí nghiệm 1) trong phiếu học tập số 1 (thời gian 10 phút). - HS nhận nhiệm vụ. Bước 2. Thực hiện nhiệm vụ học tập - HS làm việc theo nhóm. - GV quan sát, đôn đốc và hỗ trợ HS khi cần thiết. Bước 3. Báo cáo kết quả hoạt động và thảo luận - Đại diện 2 nhóm báo cáo kết quả của nhóm mình, các nhóm khác lắng nghe, nhận xét, góp ý. Bước 4. Đánh giá kết quả thực hiện nhiệm vụ - GV nhận xét, chuẩn hoá kiến thức.
Nhiệm vụ 2: Tìm hiểu về biến đổi hoá học Bước 1. Chuyển giao nhiệm vụ học tập - GV yêu cầu HS nghiên cứu SGK nêu cách tiến hành thí nghiệm sắt phản ứng với lưu huỳnh. Sau đó yêu cầu HS quan sát video thí nghiệm, thảo luận nhóm hoàn thành 4 câu hỏi (thí nghiệm 2). Thời gian làm việc 10 phút. - HS nhận nhiệm vụ. Bước 2. Thực hiện nhiệm vụ học tập - Học sinh quan sát video thí nghiệm, thảo luận theo nhóm, hoàn thành phiếu học tập. - GV quan sát, đôn đốc và hỗ trợ HS khi cần thiết. Bước 3. Báo cáo kết quả hoạt động và thảo luận - Đại diện 2 nhóm báo cáo kết quả của nhóm mình, các nhóm khác lắng nghe, nhận xét, góp ý. Bước 4. Đánh giá kết quả thực hiện nhiệm vụ - GV nhận xét, chuẩn hoá kiến thức. |
I. Biến đối vật lí và biến đổi hoá học 1. Biến đổi vật lí Các quá trình như hoà tan, đông đặc, nóng chảy, … các chất chỉ chuyển từ trạng thái này sang trạng thái khác, không tạo thành chất mới, đó là biến đổi vật lí.
2. Biến đổi hoá học Các quá trình như đốt cháy nhiên liệu, phân huỷ chất (ví dụ: nung đá vôi, …), tổng hợp chất (ví dụ: quá trình quang hợp, …) … có sự tạo thành chất mới, đó là biến đổi hoá học. Chú ý: Trong cơ thể người và động vật, sự trao đổi chất là một loạt các quá trình sinh hoá, đó là những quá trình phức tạp, bao gồm cả biến đổi vật lí và biến đổi hoá học. |
Hoạt động 3: Tìm hiểu về phản ứng hoá học
a) Mục tiêu:
- Nêu được khái niệm phản ứng hoá học, chất đầu, sản phẩm và sự sắp xếp khác nhau của các nguyên tử trong phân tử các chất.
- Tiến hành thí nghiệm và chỉ ra được một số dấu hiệu chứng tỏ có phản ứng hoá học xảy ra.
b) Nội dung:
- Học sinh hoạt động theo nhóm, nghiên cứu tài liệu, làm thí nghiệm, hoàn thành phiếu học tập số 2, từ đó lĩnh hội kiến thức.
|
PHIẾU HỌC TẬP SỐ 2 Câu 1: Than (thành phần chính là carbon) cháy trong không khí tạo thành khí carbon dioxide. a) Hãy viết phương trình phản ứng dạng chữ của phản ứng này. Chất nào là chất phản ứng? Chất nào là sản phẩm? b) Trong quá trình phản ứng, lượng chất nào giảm dần? Lượng chất nào tăng dần? Câu 2: Quan sát Hình 2.3 và trả lời câu hỏi: 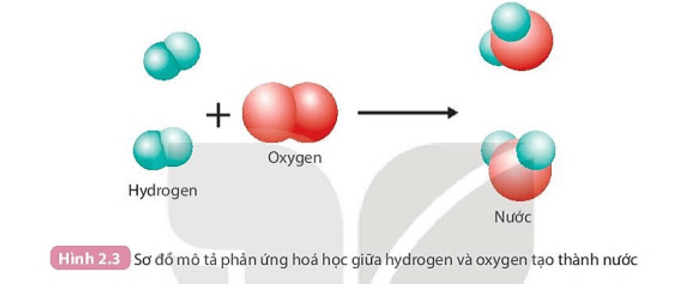
1. Trước và sau phản ứng, những nguyên tử nào liên kết với nhau? 2. Trong quá trình phản ứng, số nguyên tử H và số nguyên tử O có thay đổi không? Câu 3: Tiến hành hoạt động thí nghiệm: Dấu hiệu nhận biết có chất mới tạo thành. Quan sát hiện tượng và trả lời câu hỏi: Ống nghiệm nào xảy ra hiện tượng hoá học? Giải thích. Câu 4: Trong phản ứng giữa oxygen và hydrogen, nếu oxygen hết thì phản ứng có xảy ra nữa không? Câu 5: Nhỏ giấm ăn vào viên đá vôi. Dấu hiệu nào cho biết đã có phản ứng hoá học xảy ra? |
c) Sản phẩm:
- Câu trả lời của HS, dự kiến:
Câu 1:
a) Phương trình phản ứng dạng chữ của phản ứng:
Carbon + oxygen → carbon dioxide.
Trong đó chất phản ứng là carbon và oxygen; chất sản phẩm là carbon dioxide.
b) Trong quá trình phản ứng, lượng chất phản ứng (carbon, oxygen) giảm dần, lượng chất sản phẩm (carbon dioxide) tăng dần.
Câu 2:
1. Trước phản ứng 2 nguyên tử H liên kết với nhau, 2 nguyên tử O liên kết với nhau.
Sau phản ứng 1 nguyên tử O liên kết với 2 nguyên tử H.
2. Trong quá trình phản ứng, số nguyên tử H và số nguyên tử O không thay đổi.
Câu 3:
Ống nghiệm (1) và (3) xảy ra phản ứng hoá học do có những dấu hiệu nhận ra có chất mới tạo thành. Cụ thể:
+ Ống nghiệm (1) viên kẽm tan dần, có khí không màu thoát ra.
+ Ống nghiệm (3) có kết tủa xanh tạo thành.
Câu 4:
Trong phản ứng giữa oxygen và hydrogen, nếu oxygen hết thì phản ứng dừng lại.
Câu 5:
Nhỏ giấm ăn vào viên đá vôi. Dấu hiệu cho biết đã có phản ứng hoá học xảy ra là xuất hiện sủi bọt khí, chỗ đá vôi bị nhỏ giấm tan ra.
d) Tổ chức thực hiện:
|
HOẠT ĐỘNG CỦA GV VÀ HS |
NỘI DUNG |
|
Nhiệm vụ 1: Tìm hiểu khái niệm và diễn biến của phản ứng hoá học. Bước 1. Chuyển giao nhiệm vụ học tập - GV yêu cầu HS nghiên cứu SGK, làm việc theo nhóm, hoàn thiện câu hỏi 1, 2 trong phiếu học tập số 2. - HS nhận nhiệm vụ. Bước 2. Thực hiện nhiệm vụ học tập - HS hoạt động theo nhóm, hoàn thiện các câu hỏi 1, 2 trong phiếu học tập. - GV quan sát, đôn đốc và hỗ trợ HS khi cần thiết. Bước 3. Báo cáo kết quả hoạt động và thảo luận - Đại điện 2 nhóm báo cáo kết quả, các nhóm còn lại theo dõi, nhận xét, góp ý. Bước 4. Đánh giá kết quả thực hiện nhiệm vụ - GV tổng kết, chuẩn hoá kiến thức. Nhiệm vụ 2: Tìm hiểu hiện tượng kèm theo các phản ứng hoá học Bước 1. Chuyển giao nhiệm vụ học tập - GV yêu cầu HS nghiên cứu SGK nêu cách tiến hành thí nghiệm – SGK trang 14. Sau đó yêu cầu HS làm thí nghiệm theo nhóm và hoàn thiện các câu hỏi còn lại trong phiếu học tập số 2 (thời gian 10 phút). - HS nhận nhiệm vụ. Bước 2. Thực hiện nhiệm vụ học tập - HS làm việc theo nhóm, làm thí nghiệm và hoàn thiện các câu còn lại trong phiếu học tập số 2. - GV quan sát, theo dõi và đôn đốc và hỗ trợ HS khi cần thiết. Bước 3. Báo cáo kết quả hoạt động và thảo luận - Đại diện 3 nhóm HS trình bày kết quả 3 câu hỏi. Các HS còn lại theo dõi, nhận xét. Bước 4. Đánh giá kết quả thực hiện nhiệm vụ - GV tổng kết, chuẩn hoá kiến thức. |
II. Phản ứng hoá học 1. Khái niệm - Quá trình biến đổi từ chất này thành chất khác được gọi là phản ứng hoá học. - Chất ban đầu bị biến đổi trong phản ứng được gọi là chất phản ứng hay chất tham gia. Chất mới sinh ra được gọi là sản phẩm. - Phản ứng hoá học được biểu diễn bằng phương trình dạng chữ như sau: Tên chất phản ứng → Tên chất sản phẩm - Trong quá trình phản ứng, lượng chất phản ứng giảm dần, lượng chất sản phẩm tăng dần. - Phản ứng xảy ra hoàn toàn khi có ít nhất một chất phản ứng đã phản ứng hết. 2. Diễn biến phản ứng hoá học Trong phản ứng hoá học, xảy ra sự phá vỡ các liên kết trong phân tử chất đầu, hình thành các liên kết mới, tạo ra các phân tử mới. Kết quả là chất này biến đổi thành chất khác.
3. Hiện tượng kèm theo các phản ứng hoá học - Phản ứng hoá học xảy ra khi có chất mới được tạo thành với những tính chất mới, khác biệt với chất ban đầu. - Những dấu hiệu dễ nhận ra có chất mới tạo thành là sự thay đổi về màu sắc, xuất hiện khí hoặc xuất hiện kết tủa,… Sự toả nhiệt và phát sáng cũng là dấu hiệu cho thấy có phản ứng hoá học xảy ra. |
Hoạt động 4: Tìm hiểu về năng lượng của phản ứng hoá học
a) Mục tiêu:
- Nêu được khái niệm, đưa ra được ví dụ minh hoạ về phản ứng toả nhiệt, thu nhiệt và trình bày được các ứng dụng phổ biến của phản ứng toả nhiệt (đốt cháy than, xăng, dầu …)
b) Nội dung:
- Học sinh hoạt động theo nhóm, nghiên cứu SGK, hoàn thiện phiếu học tập số 3, từ đó lĩnh hội kiến thức.
|
PHIẾU HỌC TẬP SỐ 3 Câu 1: Thức ăn được tiêu hoá chuyển thành các chất dinh dưỡng. Phản ứng hoá học giữa chất dinh dưỡng với oxygen cung cấp năng lượng cho cơ thể hoạt động là phản ứng toả nhiệt hay thu nhiệt? Lấy thêm ví dụ về loại phản ứng này. Câu 2: Quá trình nung đá vôi (thành phần chính là CaCO3) thành vôi sống (CaO) và khí carbon dioxide (CO2) cần cung cấp năng lượng (dạng nhiệt). Đây là phản ứng toả nhiệt hay thu nhiệt? Câu 3: Các nguồn nhiên liệu hoá thạch có phải là vô tận không? Đốt cháy nhiên liệu hoá thạch ảnh hưởng đến môi trường như thế nào? Hãy nêu ví dụ về việc tăng cường sử dụng các nguồn năng lượng thay thế để giảm việc sử dụng các nhiên liệu hoá thạch. |
c) Sản phẩm:
Các câu trả lời của học sinh. Dự kiến:
Câu 1:
- Phản ứng hoá học giữa chất dinh dưỡng với oxygen cung cấp năng lượng cho cơ thể hoạt động là phản ứng toả nhiệt.
- Ví dụ một số phản ứng toả nhiệt:
+ Phản ứng đốt cháy than;
+ Phản ứng đốt cháy khí gas…
Câu 2:
Quá trình nung đá vôi (thành phần chính là CaCO3) thành vôi sống (CaO) và khí carbon dioxide (CO2) cần cung cấp năng lượng (dạng nhiệt). Đây là phản ứng thu nhiệt do khi ngừng cung cấp nhiệt phản ứng cũng dừng lại.
Câu 3:
- Các nguồn nhiên liệu hoá thạch không phải là vô tận. Các loại nhiên liệu hoá thạch mất hàng trăm triệu năm mới tạo ra được. Nếu tận thu nhiên liệu hoá thạch sẽ làm cạn kiệt nhiên liệu này trong tương lai.
- Đốt cháy nhiên liệu hoá thạch sẽ thải vào môi trường một lượng lớn các khí thải, bụi mịn và nhiều chất độc hại khác, gây ô nhiễm môi trường, phá huỷ hệ sinh thái và cảnh quan nhiên nhiên, gây các bệnh về hô hấp, mắt … cho con người.
- Một số ví dụ về việc tăng cường sử dụng các nguồn năng lượng thay thế để giảm việc sử dụng các nhiên liệu hoá thạch:
+ Sử dụng xăng sinh học E5; E10 …
+ Sử dụng năng lượng gió để chạy máy phát điện, di chuyển thuyền buồm …
+ Sử dụng năng lượng mặt trời để tạo ra điện hoặc nhiệt.
d) Tổ chức thực hiện:
|
HOẠT ĐỘNG CỦA GV VÀ HS |
NỘI DUNG |
|
Bước 1. Chuyển giao nhiệm vụ học tập - GV yêu cầu HS nghiên cứu SGK, thảo luận theo nhóm, hoàn thiện phiếu học tập số 3. - HS nhận nhiệm vụ. Bước 2. Thực hiện nhiệm vụ học tập - HS thảo luận theo nhóm, hoàn thành phiếu học tập. - GV quan sát, đôn đốc và hỗ trợ HS khi cần thiết. Bước 3. Báo cáo kết quả hoạt động và thảo luận - Đại diện 3 nhóm báo cáo kết quả thảo luận của nhóm (mỗi nhóm báo cáo một câu). - Các nhóm khác theo dõi, nhận xét, góp ý. Bước 4. Đánh giá kết quả thực hiện nhiệm vụ - GV tổng kết, chuẩn hoá kiến thức. |
III. Năng lượng của phản ứng hoá học 1. Phản ứng toả nhiệt, phản ứng thu nhiệt - Phản ứng toả nhiệt giải phóng năng lượng (dạng nhiệt) ra môi trường xung quanh. - Phản ứng thu nhiệt nhận năng lượng (dạng nhiệt) trong suốt quá trình phản ứng xảy ra. 2. Ứng dụng của phản ứng toả nhiệt Các phản ứng toả nhiệt có vai trò quan trọng trong cuộc sống vì chúng cung cấp năng lượng cho sinh hoạt và sản xuất, vận hành động cơ, thiết bị máy công nghiệp, phương tiện giao thông … |
C. LUYỆN TẬP
a) Mục tiêu:
- Hệ thống được một số kiến thức đã học.
b) Nội dung:
- HS hoạt động theo cặp đôi, hoàn thiện phiếu học tập số 4.
|
PHIẾU HỌC TẬP SỐ 4 Câu 1: Quá trình nào sau đây thể hiện sự biến đổi hoá học? A. Thanh sắt bị dát mỏng. B. Nước lỏng chuyển thành nước đá khi để trong tủ lạnh. C. Uốn sợi nhôm thành chiếc móc phơi quần áo. D. Đốt cháy mẩu giấy. Câu 2: Quá trình nào sau đây thể hiện sự biến đổi vật lí? A. Gỗ cháy thành than. B. Đun nóng đường đến khi xuất hiện chất màu đen C. Cơm bị ôi thiu. D. Hòa tan đường ăn vào nước. Câu 3: Quá trình nào sau đây có sự tạo thành chất mới? A. Đốt cháy nhiên liệu. B. Quá trình hoà tan. C. Quá trình đông đặc. D. Quá trình nóng chảy. Câu 4: Quá trình nào sau đây không có sự tạo thành chất mới? A. Quá trình đốt cháy nhiên liệu. B. Quá trình đông đặc. C. Quá trình phân huỷ chất. D. Quá trình tổng hợp chất. Câu 5: Iron (sắt) phản ứng với khí chlorine sinh ra iron(III) chloride. Phản ứng hoá học được biểu diễn bằng phương trình dạng chữ là A. Iron + chlorine → iron(III) chloride. B. Iron(III) chloride → iron + chlorine. C. Iron + iron(III) chloride → chlorine. D. Iron(III) chloride + chlorine → iron. Câu 6: Đốt đèn cồn, cồn (ethanol) cháy. Khi đó, ethanol và khí oxygen trong không khí đã tác dụng với nhau tạo thành hơi nước và khí carbon dioxide. Các chất sản phẩm có trong phản ứng này là A. ethanol và khí oxygen. B. hơi nước và khí carbon dioxide. C. ethanol và hơi nước. D. khí oxygen và khí carbon dioxide. Câu 7: Dấu hiệu nhận ra có chất mới tạo thành là A. sự thay đổi về màu sắc. B. xuất hiện chất khí. C. xuất hiện kết tủa. D. cả 3 dấu hiệu trên. Câu 8: Phản ứng thu nhiệt là A. phản ứng giải phóng năng lượng dưới dạng nhiệt. B. phản ứng hấp thụ năng lượng dưới dạng nhiệt. C. phản ứng làm tăng nhiệt độ môi trường. D. phản ứng không làm thay đổi nhiệt độ môi trường. Câu 9: Phản ứng nào sau đây là phản ứng thu nhiệt? A. Phản ứng nung đá vôi. B. Phản ứng đốt cháy cồn. C. Phản ứng đốt cháy than. D. Phản ứng đốt cháy khí hydrogen. Câu 10: Cho các phản ứng sau: (1) Phản ứng nung vôi. (2) Phản ứng phân huỷ copper(II) hydroxide. (3) Phản ứng đốt cháy khí gas. Số phản ứng thu nhiệt là A. 0. B. 1. C. 2. D. 3. |
c) Sản phẩm:
Câu trả lời của HS. Dự kiến:
|
1 – D |
2 – D |
3 – A |
4 – B |
5 – A |
6 – B |
7 – D |
8 – B |
9 – A |
10 – C |
d) Tổ chức thực hiện:
Bước 1. Chuyển giao nhiệm vụ học tập
- GV yêu cầu HS thảo luận theo cặp đôi, hoàn thành phiếu học tập số 4.
- HS nhận nhiệm vụ.
Bước 2. Thực hiện nhiệm vụ học tập
- HS thảo luận và hoàn thành phiếu học tập.
- GV quan sát, đôn đốc và hỗ trợ HS khi cần thiết.
Bước 3. Báo cáo kết quả hoạt động và thảo luận
- Đại diện HS báo cáo kết quả (mỗi HS báo cáo 1 câu, không trùng lặp). Các HS khác theo dõi, nhận xét.
Bước 4. Đánh giá kết quả thực hiện nhiệm vụ
- GV tổng kết.
D. VẬN DỤNG
a) Mục tiêu:
- Phát triển năng lực tự học và năng lực tìm hiểu đời sống.
b) Nội dung:
- HS làm việc cá nhân, tại nhà.
|
BÀI VỀ NHÀ 1. Em hãy kể thêm 2 – 3 hiện tượng (ngoài sách giáo khoa) xảy ra trong thực tế có sự biến đổi vật lí. 2. Em hãy kể thêm 2 – 3 hiện tượng (ngoài sách giáo khoa) xảy ra trong thực tế có sự biến đổi hoá học. Viết phương trình dạng chữ của các phản ứng xảy ra (nếu có thể). |
c) Sản phẩm:
- Câu trả lời của HS.
d) Tổ chức thực hiện:
Bước 1: Chuyển giao nhiệm vụ học tập
- Giáo viên yêu cầu học sinh về nhà:
|
BÀI VỀ NHÀ 1. Em hãy kể thêm 2 – 3 hiện tượng (ngoài sách giáo khoa) xảy ra trong thực tế có sự biến đổi vật lí. 2. Em hãy kể thêm 2 – 3 hiện tượng (ngoài sách giáo khoa) xảy ra trong thực tế có sự biến đổi hoá học. Viết phương trình dạng chữ của các phản ứng xảy ra (nếu có thể). |
Học sinh nộp sản phẩm vào buổi học sau.
- HS nhận nhiệm vụ.
Bước 2: Thực hiện nhiệm vụ học tập
- HS thực hiện tại nhà.
Bước 3: Báo cáo kết quả và thảo luận
- HS nộp báo cáo sản phẩm vào buổi học sau.
Bước 4: Đánh giá kết quả thực hiện nhiệm vụ
- GV nhận xét, đánh giá và có thể cho điểm với những bài làm tốt.
BÀI 3: MOL VÀ TỈ KHỐI CHẤT KHÍ
I. MỤC TIÊU
1. Năng lực
a. Năng lực khoa học tự nhiên
- Nêu được khái niệm mol, tính được khối lượng mol và chuyển đổi được giữa số mol và khối lượng.
- Nêu được khái niệm tỉ khối, viết được công thức tính tỉ khối của chất khí và so sánh được chất khí này nặng hay nhẹ hơn chất khí khác, công thức tính tỉ khối.
- Nêu được khái niệm thể tích mol của chất khí ở áp suất 1 bar và 25 oC.
- Sử dụng công thức n (mol) = để chuyển đổi giữa số mol và thể tích chất khí ở điều kiện chuẩn: áp suất 1 bar ở 25 oC.
b. Năng lực chung
+ Tự chủ và tự học: Chủ động, tích cực tìm hiểu lĩnh hội kiến thức.
+ Giao tiếp và hợp tác: Hoạt động nhóm một cách hiệu quả theo đúng yêu cầu của GV đảm bảo các thành viên trong nhóm đều được tham gia và trình bày báo cáo.
+ Giải quyết vấn đề và sáng tạo: Thảo luận với các thành viên trong nhóm nhằm giải quyết các vấn đề trong bài học để hoàn thành nhiệm vụ học tập.
2. Phẩm chất
- Hứng thú, tự giác, chủ động, sáng tạo trong tiếp cận kiến thức mới qua sách vở và thực tiễn.
- Trung thực, cẩn thận trong học tập.
- Có ý thức sử dụng hợp lý và bảo vệ nguồn tài sản chung.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
1. Giáo viên
- Hình ảnh phóng to các hình ảnh trong SGK.
- Thiết kế phiếu học tập, slide.
- Máy tính, máy chiếu …
2. Học sinh
- SGK, vở ghi.
- Ôn tập bài cũ và chuẩn bị bài mới trước khi đến lớp.
III. TIẾN TRÌNH DẠY HỌC
A. KHỞI ĐỘNG
Hoạt động 1: Mở đầu
a. Mục tiêu: Khơi gợi kiến thức cũ, tạo tâm thế hứng thú cho học sinh và từng bước làm quen bài mới.
b. Nội dung: HS hoạt động cá nhân, trả lời câu hỏi mở đầu – SGK trang 16, từ đó hình thành mục tiêu bài học.
|
MỞ ĐẦU Bằng phép đo thông thường, ta chỉ xác định được khối lượng chất rắn, chất lỏng hoặc thể tích của chất khí. Làm thế nào để biết lượng chất có bao nhiêu phân tử, nguyên tử? |
c. Sản phẩm:
- Câu trả lời của HS. Dự kiến:
Để biết được lượng chất có bao nhiêu phân tử, nguyên tử ta cần sử dụng khái niệm mol.
d. Tổ chức thực hiện:
Bước 1. Chuyển giao nhiệm vụ học tập
- GV yêu cầu HS hoạt động cá nhân, suy nghĩ và trả lời câu hỏi: Bằng phép đo thông thường, ta chỉ xác định được khối lượng chất rắn, chất lỏng hoặc thể tích của chất khí. Làm thế nào để biết lượng chất có bao nhiêu phân tử, nguyên tử?
- HS nhận nhiệm vụ.
Bước 2. Thực hiện nhiệm vụ học tập
- HS nghiên cứu SGK, suy nghĩ tìm câu trả lời.
- GV quan sát, đôn đốc HS.
Bước 3. Báo cáo kết quả hoạt động và thảo luận
- Đại diện HS trả lời, các HS khác chú ý lắng nghe (góp ý nếu có).
Bước 4. Đánh giá kết quả thực hiện nhiệm vụ
- Câu trả lời của HS có thể đúng hoặc sai, GV không nhận xét tính đúng/ sai mà dựa vào đó để dẫn vào bài học.
B. HÌNH THÀNH KIẾN THỨC MỚI
Hoạt động 2: Tìm hiểu khái niệm mol
a) Mục tiêu:
- Nêu được khái niệm mol.
- Tính được số mol dựa vào số hạt (nguyên tử hoặc phân tử …) và ngược lại.
b) Nội dung:
- HS nghiên cứu thông tin trong SGK, thảo luận theo nhóm, hoàn thành phiếu học tập số 1 từ đó lĩnh hội kiến thức.
|
PHIẾU HỌC TẬP SỐ 1 Câu 1: Mol là gì? Thiết lập công thức tính mol của một lượng chất có chứa N hạt. Câu 2: Đọc thông tin Hình 3.1 và so sánh khối lượng của 1 mol nguyên tử carbon, 1 mol phân tử iodine và 1 mol phân tử nước. Câu 3: Tính số nguyên tử, phân tử có trong mỗi lượng chất sau: a) 0,25 mol nguyên tử C; b) 0,002 mol phân tử I2; c) 2 mol phân tử H2O. Câu 4: Một lượng chất sau đây tương đương bao nhiêu mol nguyên tử hoặc mol phân tử? a) 1,2044 . 1022 phân tử Fe2O3; b) 7,5275 . 1024 nguyên tử Mg. |
c) Sản phẩm:
Câu trả lời của học sinh. Dự kiến.
Câu 1: Mol là lượng chất có chứa NA (6,022.1023) nguyên tử hoặc phân tử của chất đó.
Câu 2:
+ Khối lượng 1 mol nguyên tử carbon là 12 gam.
+ Khối lượng 1 mol phân tử iodine là 254 gam.
+ Khối lượng 1 mol phân tử nước là 18 gam.
Vậy khối lượng 1 mol nguyên tử carbon < khối lượng 1 mol phân tử nước < khối lượng 1 mol phân tử iodine.
Câu 3:
Ta có mol là lượng chất có chứa NA (6,022 × 1023) nguyên tử hoặc phân tử của chất đó. Vậy:
a) 0,25 mol nguyên tử C có 0,25 × 6,022 × 1023 = 1,5055 × 1023 nguyên tử C.
b) 0,002 mol phân tử I2 có 0,002 × 6,022 × 1023 = 1,2044 × 1021 phân tử I2.
c) 2 mol phân tử H2O có 2 × 6,022 × 1023 = 1,2044 × 1024 phân tử H2O.
Câu 4:
Ta có mol là lượng chất có chứa NA (6,022 × 1023) nguyên tử hoặc phân tử của chất đó. Vậy:
a) 1,2044 . 1022 phân tử Fe2O3 tương đương với mol phân tử Fe2O3.
b) 7,5275 . 1024 nguyên tử Mg tương đương với mol nguyên tử Mg.
d) Tổ chức thực hiện:
|
HOẠT ĐỘNG CỦA GV VÀ HS |
NỘI DUNG |
|
Bước 1. Chuyển giao nhiệm vụ học tập - GV yêu cầu HS nghiên cứu SGK, làm việc theo nhóm, hoàn thành phiếu học tập số 1 (thời gian 10 phút). - HS nhận nhiệm vụ. Bước 2. Thực hiện nhiệm vụ học tập - HS thảo luận nhóm, hoàn thành phiếu học tập. - GV quan sát, đôn đốc và hỗ trợ HS khi cần thiết. Bước 3. Báo cáo kết quả hoạt động và thảo luận - Lần lượt 4 HS đại diện 4 nhóm trình bày kết quả từng câu (mỗi HS trình bày 1 câu). - Các HS còn lại theo dõi, nhận xét (góp ý nếu có). Bước 4. Đánh giá kết quả thực hiện nhiệm vụ - GV tổng kết, chuẩn hoá kiến thức. |
I. Mol 1. Khái niệm Mol là lượng chất có chứa NA (6,022.1023) nguyên tử hoặc phân tử của chất đó. |
Hoạt động 3: Tìm hiểu khối lượng mol
a) Mục tiêu:
- Tính được khối lượng mol và chuyển đổi được giữa số mol và khối lượng.
b) Nội dung:
- HS làm việc theo nhóm, nghiên cứu SGK, hoàn thiện phiếu học tập số 2, từ đó lĩnh hội kiến thức.
|
PHIẾU HỌC TẬP SỐ 2 Câu 1: Khối lượng mol của một chất là gì? Mối liên hệ giữa khối lượng mol của một chất với khối lượng nguyên tử (hoặc phân tử) chất đó? Câu 2: Tính khối lượng mol của chất X, biết rằng 0,4 mol chất này có khối lượng 23,4 gam. Câu 3: Tính số mol phân tử có trong 9 gam nước, biết rằng khối lượng mol của nước là 18 g/ mol. Câu 4: Calcium carbonate có công thức hoá học là CaCO3. a) Tính khối lượng phân tử của calcium carbonate. b) Tính khối lượng của 0,2 mol calcium carbonate. |
c) Sản phẩm:
Câu trả lời của học sinh. Dự kiến:
Câu 1:
- Khối lượng mol (kí hiệu là M) của một chất là khối lượng của NA nguyên tử hoặc phân tử chất đó tính theo đơn vị gam.
- Khối lượng mol (g/ mol) của một chất và khối lượng nguyên tử (hoặc phân tử) của chất đó (amu) bằng nhau về trị số, khác về đơn vị đo.
Câu 2:
Khối lượng mol của chất X là:
Áp dụng công thức:
Câu 3:
Số mol phân tử có trong 9 gam nước là:
Áp dụng công thức:
Câu 4:
a) Khối lượng phân tử của calcium carbonate:
40 + 12 + 16 × 3 = 100 (amu).
b) Khối lượng của 0,2 mol calcium carbonate là:
Áp dụng công thức:
d) Tổ chức thực hiện:
|
HOẠT ĐỘNG CỦA GV VÀ HS |
NỘI DUNG |
|
Bước 1. Chuyển giao nhiệm vụ học tập - GV yêu cầu HS nghiên cứu SGK, làm việc theo nhóm, hoàn thành phiếu học tập số 2 (thời gian 10 phút). - HS nhận nhiệm vụ. Bước 2. Thực hiện nhiệm vụ học tập - HS thảo luận nhóm, hoàn thành phiếu học tập. - GV quan sát, đôn đốc và hỗ trợ HS khi cần thiết. Bước 3. Báo cáo kết quả hoạt động và thảo luận - 4 HS đại diện 4 nhóm trình bày kết quả từng câu (mỗi HS trình bày 1 câu). - Các HS còn lại theo dõi, nhận xét (góp ý nếu có). Bước 4. Đánh giá kết quả thực hiện nhiệm vụ - GV tổng kết, chuẩn hoá kiến thức. |
2. Khối lượng mol - Khối lượng mol (kí hiệu là M) của một chất là khối lượng của NA nguyên tử hoặc phân tử chất đó tính theo đơn vị gam. - Khối lượng mol (g/ mol) của một chất và khối lượng nguyên tử (hoặc phân tử) của chất đó (amu) bằng nhau về trị số, khác về đơn vị đo. - Gọi n là số mol chất có trong m gam. Khối lượng mol (M) được tính theo công thức: M = |
Hoạt động 4: Tìm hiểu về thể tích mol của chất khí
a) Mục tiêu:
- Nêu được khái niệm thể tích mol của chất khí ở áp suất 1 bar và 25 oC.
- Tính được thể tích mol chất khí ở điều kiện chuẩn khi biết số mol và ngược lại.
b) Nội dung:
- HS làm việc theo nhóm, nghiên cứu SGK, hoàn thiện phiếu học tập số 3, từ đó lĩnh hội kiến thức.
|
PHIẾU HỌC TẬP SỐ 3 Câu 1: Thể tích mol của chất khí là gì? Ở điều kiện chuẩn, n mol khí chiếm thể tích là bao nhiêu? Câu 2: Ở 25 oC và 1 bar, 1,5 mol khí chiếm thể tích bao nhiêu? Câu 3: Một hỗn hợp khí gồm 1 mol khí oxygen với 4 mol khí nitrogen. Ở 25oC và 1 bar, hỗn hợp này có thể tích là bao nhiêu? Câu 4: Tính số mol khí chứa trong bình có thể tích 500 mililít ở 25 oC và 1 bar. |
c) Sản phẩm:
Câu 1:
- Thể tích mol của chất khí là thể tích chiếm bởi NA phân tử của chất khí đó.
- Ở điều kiện chuẩn, n mol khí chiếm thể tích là: V = 24,79.n (L).
Câu 2:
Ở điều kiện chuẩn (25 oC và 1 bar), 1 mol khí bất kì đều chiếm thể tích là 24,79 lít.
Vậy 1,5 mol khí ở điều kiện này chiếm thể tích V = 1,5 × 24,79 = 37,185 lít.
Câu 3:
Tổng số mol khí trong hỗn hợp là: 1 + 4 = 5 (mol).
Ở điều kiện chuẩn (25 oC và 1 bar), 1 mol khí bất kì đều chiếm thể tích là 24,79 lít.
Vậy 5 mol hỗn hợp khí ở điều kiện này chiếm thể tích:
V = 5 × 24,79 = 123,95 (lít).
Câu 4:
Ở điều kiện chuẩn (25 oC và 1 bar), 1 mol khí bất kì đều chiếm thể tích là 24,79 lít.
Đổi 500 mililít = 0,5 lít.
Số mol khí chứa trong bình có thể tích 0,5 lít ở điều kiện chuẩn là:
Áp dụng công thức: V = n × 24,79
Þ
d) Tổ chức thực hiện:
|
HOẠT ĐỘNG CỦA GV VÀ HS |
NỘI DUNG |
|
Bước 1. Chuyển giao nhiệm vụ học tập - GV yêu cầu HS nghiên cứu SGK, làm việc theo nhóm, hoàn thành phiếu học tập số 3 (thời gian 10 phút). - HS nhận nhiệm vụ. Bước 2. Thực hiện nhiệm vụ học tập - HS thảo luận nhóm, hoàn thành phiếu học tập. - GV quan sát, đôn đốc và hỗ trợ HS khi cần thiết. Bước 3. Báo cáo kết quả hoạt động và thảo luận - 4 HS đại diện 4 nhóm trình bày kết quả từng câu (mỗi HS trình bày 1 câu). - Các HS còn lại theo dõi, nhận xét (góp ý nếu có). Bước 4. Đánh giá kết quả thực hiện nhiệm vụ - GV tổng kết, chuẩn hoá kiến thức. |
3. Thể tích mol của chất khí - Thể tích mol của chất khí là thể tích chiếm bởi NA phân tử của chất khí đó. - Thể tích mol của các chất khí bất kì ở cùng điều kiện nhiệt độ và áp suất đều bằng nhau. - Ở điều kiện chuẩn (25 oC và 1 bar), 1 mol khí bất kì đều chiếm thể tích là 24,79 lít. - Ở điều kiện chuẩn, n mol khí chiếm thể tích là: V = 24,79.n (L).
|
Hoạt động 5: Tỉ khối chất khí
a) Mục tiêu:
- Nêu được khái niệm tỉ khối, viết được công thức tính tỉ khối của chất khí và so sánh được chất khí này nặng hay nhẹ hơn chất khí khác, công thức tính tỉ khối.
b) Nội dung:
- Học sinh hoạt động theo nhóm, hoàn thành phiếu học tập số 4, từ đó lĩnh hội kiến thức.
|
PHIẾU HỌC TẬP SỐ 4 Câu 1: Tỉ khối của khí A đối với khí B được biểu diễn bằng công thức nào? Tỉ khối của khí A đối với khí B cho biết điều gì? Câu 2: a) Khí carbon dioxide (CO2) nặng hay nhẹ hơn không khí bao nhiêu lần? b) Trong lòng hang sâu thường xảy ra quá trình phân huỷ chất vô cơ hoặc hữu cơ, sinh ra khí carbon dioxide. Hãy cho biết khí carbon dioxide tích tụ ở trên nền hang hay bị không khí đẩy bay lên trên. Câu 3: a) Khí methane (CH4) nặng hơn hay nhẹ hơn không khí bao nhiêu lần? b) Dưới đáy giếng thường xảy ra quá trình phân huỷ chất hữu cơ, sinh ra khí methane. Hãy cho biết khí methane tích tụ dưới đáy giếng hay bị không khí đẩy bay lên trên. |
c) Sản phẩm:
Câu 1:
Tỉ số giữa khối lượng mol của khí A (MA) và khối lượng mol của khí B (MB) được gọi là tỉ khối của khí A đối với khí B:
Tỉ khối của khí A so với khí B cho biết khí A nặng hay nhẹ hơn khí B khoảng bao nhiêu lần.
Câu 2:
a) Khối lượng phân tử CO2: 12 + 16 . 2 = 44 (amu).
Tỉ khối của khí carbon dioxide so với không khí:
Vậy khí carbon dioxide nặng hơn không khí khoảng 1,52 lần.
b) Trong lòng hang sâu thường xảy ra quá trình phân huỷ chất vô cơ hoặc hữu cơ, sinh ra khí carbon dioxide. Do nặng hơn không khí khoảng 1,52 lần nên khí carbon dioxide tích tụ ở trên nền hang.
Câu 3:
a) Khối lượng phân tử khí methane: 12 + 4 . 1 = 16 (amu).
Tỉ khối của khí methane so với không khí:
Vậy khí methane nhẹ hơn không khí khoảng 0,55 lần.
b) Dưới đáy giếng thường xảy ra quá trình phân huỷ chất hữu cơ, sinh ra khí methane. Do nhẹ hơn không khí nên khí methane sẽ không tích tụ dưới đáy giếng mà bị không khí đẩy bay lên trên.
d) Tổ chức thực hiện:
|
HOẠT ĐỘNG CỦA GV VÀ HS |
NỘI DUNG |
|
Bước 1. Chuyển giao nhiệm vụ học tập - GV yêu cầu HS nghiên cứu SGK, làm việc theo nhóm, hoàn thành phiếu học tập số 4 (thời gian 10 phút). - HS nhận nhiệm vụ. Bước 2. Thực hiện nhiệm vụ học tập - HS thảo luận nhóm, hoàn thành phiếu học tập. - GV quan sát, đôn đốc và hỗ trợ HS khi cần thiết. Bước 3. Báo cáo kết quả hoạt động và thảo luận - 3 HS đại diện 3 nhóm trình bày kết quả từng câu (mỗi HS trình bày 1 câu). - Các HS còn lại theo dõi, nhận xét (góp ý nếu có). Bước 4. Đánh giá kết quả thực hiện nhiệm vụ - GV tổng kết, chuẩn hoá kiến thức. |
II. Tỉ khối chất khí - Để xác định khí A nặng hay nhẹ hơn khí B bao nhiêu lần, ta dựa vào tỉ số giữa khối lượng mol của khí A (MA) và khối lượng mol của khí B (MB). - Tỉ số giữa khối lượng mol của khí A (MA) và khối lượng mol của khí B (MB) được gọi là tỉ khối của khí A đối với khí B: - Tỉ khối của khí A so với không khí là: |
C. LUYỆN TẬP
a) Mục tiêu:
- Hệ thống được một số kiến thức đã học.
b) Nội dung:
- HS hoạt động theo cặp đôi, hoàn thiện phiếu học tập số 5, từ đó củng cố được kiến thức.
PHIẾU HỌC TẬP SỐ 5
Câu 1: Thể tích mol của chất khí phụ thuộc vào yếu tố nào dưới đây?
A. Khối lượng mol của chất khí.
B. Nhiệt độ và áp suất của chất khí.
C. Bản chất, nhiệt độ và áp suất của chất khí.
D. Khối lượng riêng của chất khí.
Câu 2: Khối lượng mol của một chất là gì?
A. Là khối lượng ban đầu của chất đó.
B. Là khối lượng sau khi tham gia phản ứng hóa học.
C. Bằng 6.1023.
D. Là khối lượng tính bằng gam của NA nguyên tử hoặc phân tử chất đó.
Câu 3: 1 mol chất khí bất kì ở điều kiện chuẩn có thể tích là
A. 2,479 lít. B. 0,224 lít.
C. 24,79 lít. D. 24,79 ml.
Câu 4: Điều kiện nào sau đây là điều kiện chuẩn?
A. Nhiệt độ 0oC, áp suất 1 bar.
B. Nhiệt độ 20oC, áp suất 1 atm.
C. Nhiệt độ 0oC, áp suất 1 atm.
D. Nhiệt độ 25oC, áp suất 1 bar.
Câu 5: Ở điều kiện chuẩn thể tích của 2,5 mol khí O2 là
A. 24,79 lít. B. 61,975 lít.
C. 6,1975 lít . D. 50,4 lít.
Câu 6: Khối lượng mol của phân tử Fe2O3 là
A. 72 g/mol. B. 120 g/mol.
C. 160 g/mol. D. 233 g/mol.
Câu 7: Phải lấy bao nhiêu mol phân tử CO2 để có 1,5.1023 phân tử CO2?
A. 0,20 mol. B. 0,25 mol.
C. 0,30 mol. D. 0,35 mol.
Câu 8: Số mol nước có trong 36 gam nước là
A. 1 mol. B. 1,5 mol.
C. 2 mol. D. 2,5 mol.
Câu 9: Trong các khí sau: CO2, N2, H2, SO2 có bao nhiêu chất khí nhẹ hơn không khí:
A. 5. B. 4.
C. 3. D. 2.
Câu 10: Khí SO2 nặng hay nhẹ hơn không khí bao nhiêu lần?
A. Nặng hơn không khí 2,2 lần.
B. Nhẹ hơn không khí 3 lần.
C. Nặng hơn không khí 2,4 lần.
D. Nhẹ hơn không khí 2 lần.
c) Sản phẩm:
|
1 - B |
2 - D |
3 - C |
4 - D |
5 - B |
6 - C |
7 - B |
8 - C |
9 - D |
10 - A |
d) Tổ chức thực hiện:
Bước 1. Chuyển giao nhiệm vụ học tập
- GV yêu cầu HS thảo luận theo cặp đôi, hoàn thành phiếu học tập số 5.
- HS nhận nhiệm vụ.
Bước 2. Thực hiện nhiệm vụ học tập
- HS thảo luận và hoàn thành phiếu học tập.
- GV quan sát, đôn đốc và hỗ trợ HS khi cần thiết.
Bước 3. Báo cáo kết quả hoạt động và thảo luận
- Đại diện HS báo cáo kết quả (mỗi HS báo cáo 1 câu, không trùng lặp). Các HS khác theo dõi, nhận xét.
Bước 4. Đánh giá kết quả thực hiện nhiệm vụ
- GV tổng kết.
D. VẬN DỤNG
a) Mục tiêu:
- Phát triển năng lực tự học và năng lực tìm hiểu đời sống.
b) Nội dung:
- HS làm việc cá nhân, tại nhà.
|
BÀI VỀ NHÀ Em hãy nêu các nguy cơ mất an toàn và một số biện pháp phòng tránh rủi ro khi nạo vét giếng, thám hiểm hang động … |
c) Sản phẩm:
- Câu trả lời của HS. Dự kiến:
Các giếng nước hay hang động, hầm lò sâu … thường có nhiều khí độc tích tụ như CO2; H2S … Hàng năm, nước ta có rất nhiều vụ tử vong thương tâm do ngạt khí khi nạo vét giếng … Do vậy, đối với những giếng nước, hang động, hầm lò sâu chúng ta luôn phải cảnh giác, trước khi đưa người xuống cần phải thăm dò xem không khí dưới đó có thở được không.
Ví dụ một số cách thử trước khi xuống nạo, vét giếng như:
+ Thắp một ngọn nến, dòng dây thả dần sát xuống mặt nước nếu ngọn nến vẫn cháy sáng bình thường là không khí dưới đáy giếng có đủ oxygen, người có thể xuống được. Nếu ngọn nến chỉ cháy leo lét rồi tắt thì không nên xuống vì dưới đó thiếu oxygen hoặc phải trang bị bình dưỡng khí trước khi xuống.
+ Nhốt một con vật vào lồng, buộc dây thả gần sát mặt giếng, nếu con vật bị chết ngạt chứng tỏ không khí dưới đáy giếng thiếu oxygen …
d) Tổ chức thực hiện:
Bước 1: Chuyển giao nhiệm vụ học tập
- Giáo viên yêu cầu học sinh về nhà:
|
BÀI VỀ NHÀ Em hãy nêu các nguy cơ mất an toàn và một số biện pháp phòng tránh rủi ro khi nạo vét giếng, thám hiểm hang động … |
Học sinh nộp báo cáo vào buổi học sau.
- HS nhận nhiệm vụ.
Bước 2: Thực hiện nhiệm vụ học tập
- HS thực hiện tại nhà.
Bước 3: Báo cáo kết quả và thảo luận
- HS nộp báo cáo sản phẩm vào buổi học sau.
Bước 4: Đánh giá kết quả thực hiện nhiệm vụ
- GV nhận xét, đánh giá và có thể cho điểm với những bài làm tốt.
................................
................................
................................
