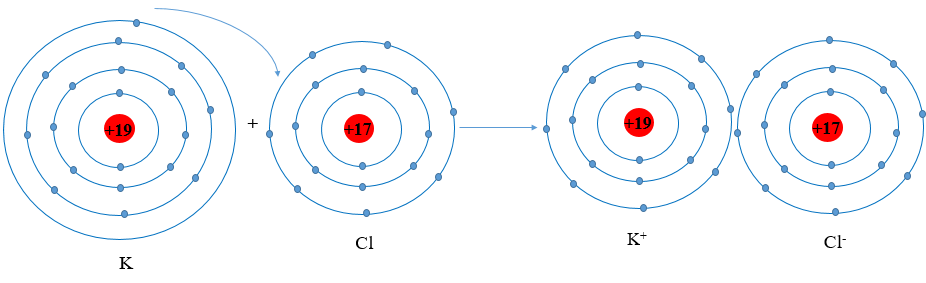
Vận dụng quy tắc octet, trình bày sơ đồ mô tả sự hình thành phân tử
Giải Hóa 10 Bài 8: Quy tắc octet
Haylamdo biên soạn và sưu tầm lời giải Bài 3 trang 54 Hóa học 10 trong Bài 8: Quy tắc octet, lời giải chi tiết sẽ giúp học sinh biết cách làm bài tập Hóa học 10.
Bài 3 trang 54 Hóa học 10: Vận dụng quy tắc octet, trình bày sơ đồ mô tả sự hình thành phân tử potassium chloride (KCl) từ nguyên tử của các nguyên tố potassium và chlorine.
Lời giải:
- Nguyên tử K (Z = 19): 1s22s22p63s23p64s1 ⇒ Có 1 electron lớp ngoài cùng ⇒ Có xu hướng nhường 1 electron này để đạt cấu hình electron giống khí hiếm.
Phần tử thu được mang điện tích dương, gọi là ion potassium, kí hiệu K+
- Nguyên tử Cl (Z = 17): 1s22s22p63s23p5 ⇒ Có 7 electron lớp ngoài cùng ⇒ Có xu hướng nhận 1 electron từ nguyên tử K để đạt cấu hình electron giống khí hiếm.
Phần tử thu được mang điện tích âm, gọi là ion chlorine, kí hiệu, Cl-
- Hai ion trái dấu hút nhau tạo thành phân tử potassium chloride (KCl)
- Sơ đồ mô tả: