So sánh nhiệt độ sôi và khả năng hòa tan trong nước giữa NH3 và CH4
Giải Hóa 10 Bài 11: Liên kết hydrogen và tương tác van der waals
Haylamdo biên soạn và sưu tầm lời giải Câu hỏi 4 trang 68 Hóa học 10 trong Bài 11: Liên kết hydrogen và tương tác van der waals, lời giải chi tiết sẽ giúp học sinh biết cách làm bài tập Hóa học 10.
Câu hỏi 4 trang 68 Hóa học 10: So sánh nhiệt độ sôi và khả năng hòa tan trong nước giữa NH3 và CH4. Giải thích
Lời giải:
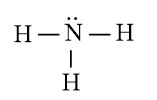
Công thức Lewis của NH3:
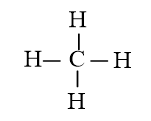
Công thức Lewis của CH4:
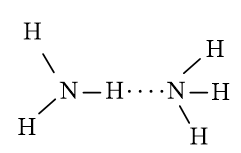
- Nhiệt độ sôi: Nguyên tử N có độ âm điện lớn làm cho liên kết N-H phân cực mạnh, trong phân tử NH3 nguyên tử N còn cặp electron chưa liên kết nên có thể tạo liên kết hydrogen giữa các phân tử NH3 với nhau. Mặt khác, C có độ âm điện nhỏ nên liên kết C-H phân cực yếu, nguyên tử C không còn cặp electron chưa liên kết nên không có khả năng tạo liên kết hydrogen giữa các phân tử CH4 với nhau. Điều này khiến cho nhiệt độ sôi của NH3 cao hơn của CH4.
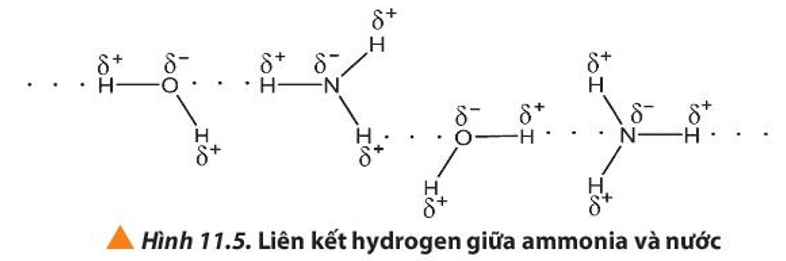
- Khả năng hòa tan trong nước: Giải thích tương tự như nhiệt độ sôi. Phân tử NH3 có thể tạo liên kết hydrogen với nước còn CH4 thì không. Do đó NH3 tan tốt trong nước hơn CH4.