Cho phản ứng: Br2 (l) + HCOOH (aq) suy ra 2HBr (aq) + CO2 (s) Nồng độ ban đầu của Br2 là aM
Câu hỏi:
Cho phản ứng: Br2 (l) + HCOOH (aq) 2HBr (aq) + CO2 (s)
Nồng độ ban đầu của Br2 là aM, sau 50 giây nồng độ Br2 còn lại là 0,02M. Tốc độ trung bình của phản ứng trên là 4.10-5M/s. Giá trị của a là
A. 0,02 M;
B. 0,07 M;
C. 0,02 M;
D. 0,022 M.
Trả lời:
Đáp án đúng là:
Áp dụng công thức tính tốc độ trung bình của phản ứng, ta có:
 =
= 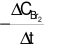
Do đó 4.10-5 = 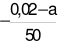 ⇒ a = 0,022 (M)
⇒ a = 0,022 (M)
Xem thêm bài tập trắc nghiệm Hóa 10 CTST có lời giải hay khác:
Câu 3:
Biểu thức tốc độ trung bình của phản ứng: aA + bB ⟶ cC + dD là
Xem lời giải »
Câu 4:
Cho phản ứng ở 45°C
2N2O5 (g) ⟶ O2 (g) + 2N2O4 (g)
Sau 275 giây đầu tiên, nồng độ của O2 là 0,188 M. Tính tốc độ trung bình của phản ứng theo O2 trong khoảng thời gian trên.
Xem lời giải »
Câu 5:
Cho phản ứng: 2H2O2 (aq) O2 (s) +2H2O (l)
O2 (s) +2H2O (l)
Cho chất xúc tác MnO2 vào 100 ml dung dịch H2O2, sau 60 giây thu được 33,6 ml khí O2 (ở đktc). Tốc độ trung bình của phản ứng (tính theo H2O2) trong 60 giây trên là
Xem lời giải »
Câu 6:
Hiện tượng nào dưới đây xảy ra với tốc độ nhanh nhất?
Xem lời giải »
 =
= 
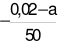 ⇒ a = 0,022 (M)
⇒ a = 0,022 (M)
 O2 (s) +2H2O (l)
O2 (s) +2H2O (l)