Cũng giống như nam châm, mỗi nguyên tử/ ion cũng có thể có từ tính
Giải SBT Hóa học 10 Bài 5: Lớp, phân lớp và cấu hình electron
Haylamdo biên soạn và sưu tầm lời giải Bài 5.18 trang 16 sách bài tập Hóa học 10 trong Bài 5: Lớp, phân lớp và cấu hình electron sách Cánh diều. Với lời giải chi tiết hy vọng sẽ giúp các học sinh dễ dàng nắm được cách làm bài tập trong SBT Hóa học 10.
Bài 5.18 trang 16 sách bài tập Hóa học 10: Cũng giống như nam châm, mỗi nguyên tử/ ion cũng có thể có từ tính (bị nam châm hút). Nếu nguyên tử/ ion có electron độc thân thì nó có từ tính và được gọi là chất thuận từ. Ngược lại, nguyên tử/ ion nếu không có electron độc thân thì được gọi là chất nghịch từ. Hãy giải thích vì sao nguyên tử Cu (Z = 29) thuận từ nhưng ion Cu+ lại nghịch từ.
Lời giải:
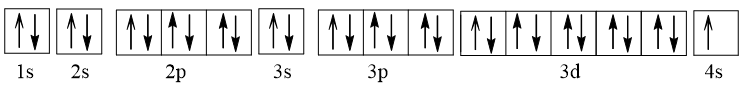
- Cấu hình electron của Cu (Z = 29): 1s22s22p63s23p63d104s1.
Viết gọn: [Ar]3d104s1.
Biểu diễn dưới dạng ô orbital nguyên tử:
Như vậy Cu có 1 electron độc thân nên thuận từ.
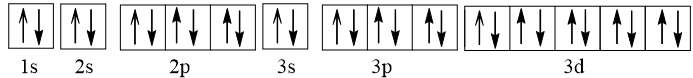
- Cu nhường đi 1 electron tạo thành ion Cu+ có cấu hình electron: 1s22s22p63s23p63d10.
Viết gọn: [Ar]3d10.
Biểu diễn dưới dạng ô orbital nguyên tử:
Như vậy Cu+ không có electron độc thân nên nghịch từ.