Lithium fluoride LiF và sodium chloride NaCl đều là các hợp chất ion
Giải SBT Hóa 10 Ôn tập chương 3
Haylamdo biên soạn và sưu tầm lời giải Bài OT 3.6 trang 42 trong Ôn tập chương 3 sách Chân trời sáng tạo. Với lời giải chi tiết nhất hy vọng sẽ giúp học sinh dễ dàng nắm được cách làm bài tập Sách bài tập Hóa 10.
Bài OT 3.6 trang 42 SBT Hóa học 10: Lithium fluoride (LiF) và sodium chloride (NaCl) đều là các hợp chất ion. Dự đoán nhiệt độ sôi và nhiệt độ nóng chảy của chất nào cao hơn. Giải thích.
Lời giải:
Lực hút tĩnh điện mạnh giữa các ion âm và ion dương làm cho LiF và NaCl đều có nhiệt độ nóng chảy và nhiệt độ sôi cao. Do các ion lithium và sodium đều mang điện tích +1, các ion fluoride và chloride đều mang điện tích -1 nên lực hút tĩnh điện ở đây phụ thuộc vào khoảng cách ion giữa các phân tử. Nếu các ion càng nhỏ, chúng càng gần nhau hơn dẫn đến lực hút tĩnh điện lớn hơn.
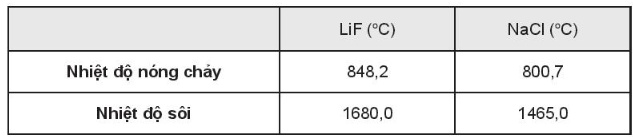
Do kích thước của ion Na+ lớn hơn ion Li+, kích thước ion Cl- lớn hơn ion F- nên lực hút tĩnh điện giữa các ion trong phân tử LiF lớn hơn trong phân tử NaCl làm nhiệt độ sôi và nhiệt độ nóng chảy của LiF cao hơn NaCl.
Bảng số liệu tham khảo: