Tại sao ở điều kiện thường (25 °C, 1 bar) nitrogen tồn tại ở dạng phân tử N2
Sách bài tập Hóa học 11 Bài 3: Đơn chất nitrogen - Chân trời sáng tạo
Bài 3.8 trang 17 Sách bài tập Hóa học 11: Tại sao ở điều kiện thường (25 °C, 1 bar), nitrogen tồn tại ở dạng phân tử N2 trong khi đó phosphorus lại tồn tại ở dạng P4 mà không xảy ra trường hợp ngược lại? Biết:
- Năng lượng liên kết ba N ≡ N là 941 kJ/mol.
- Năng lượng liên kết ba P ≡ P là 490 kJ/mol.
- Năng lượng liên kết đơn N-N là 160 kJ/mol.
- Năng lượng liên kết đơn P-P là 209 kJ/mol.
Lời giải:
Xét phân tử P4. Phân tử P4 (phosphorus trắng) là một tứ diện trong đó gồm 4 nguyên tử P chiếm 4 đỉnh, liên kết với nhau bằng 6 liên kết đơn P-P
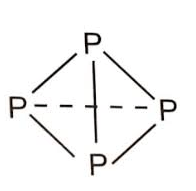
Bốn nguyên tử P kết hợp với nhau để tạo thành phân tử P4 sẽ giải phóng năng lượng là: 6.209 = 1 254 (kJ).
Nếu 4 nguyên tử P kết hợp với nhau để tạo thành 2 phân tử P≡P thì sẽ giải phóng năng lượng là: 2.490 = 980 (kJ).
Phân tử P4 bền hơn P2 nên ở điều kiện thường, phosphorus trắng tồn tại ở dạng phân tử P4.
Xét phân tử N2: Tính tương tự như trên, năng lượng được giải phóng khi tạo thành một phân tử N4 từ 4 nguyên tử N là: 6.160 = 960 (kJ).
Năng lượng được giải phóng khi tạo thành 2 phân tử N2 từ bốn nguyên tử N là: 2.941 = 1 882 (kJ).
Phân tử N2 bền hơn N4 ở điều kiện thường.
Lời giải SBT Hóa 11 Bài 3: Đơn chất nitrogen hay khác:
Bài 3.1 trang 16 Sách bài tập Hóa học 11: Ở trạng thái tự nhiên, nitrogen ....
Bài 3.2 trang 16 Sách bài tập Hóa học 11: Cấu hình electron nguyên tử của nitrogen là ....
Bài 3.3 trang 16 Sách bài tập Hóa học 11: Tính chất nào sau đây của nitrogen không đúng? ....
Bài 3.4 trang 16 Sách bài tập Hóa học 11: Nitrogen trong không khí có vai trò nào sau đây? ....

