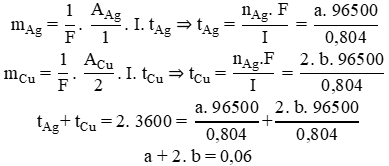Điện phân 500 mL dung dịch X gồm Cu(NO3)2 và AgNO3 với cường độ dòng điện 0,804 A
Điện phân 500 mL dung dịch X gồm Cu(NO) và AgNO với cường độ dòng điện 0,804 A cho đến khi bọt khí bắt đầu thoát ra ở cathode thì mất 2 giờ, khi đó khối lượng cathode tăng thêm 4,2 g. Nồng độ mol của Cu(NO) trong dung dịch X là bao nhiêu?
Sách bài tập Hóa học 12 Bài 16: Điện phân - Kết nối tri thức
Câu 16.36 trang 59 SBT Hóa học 12: Điện phân 500 mL dung dịch X gồm Cu(NO3)2 và AgNO3 với cường độ dòng điện 0,804 A cho đến khi bọt khí bắt đầu thoát ra ở cathode thì mất 2 giờ, khi đó khối lượng cathode tăng thêm 4,2 g. Nồng độ mol của Cu(NO3)2 trong dung dịch X là bao nhiêu?
Lời giải:
Ở cathode: Ag+ + e → Ag
Cu2+ + 2e → Cu
Ở anode: 2H2O → 4H+ + O2 + 4e.
Đến khi bọt khí bắt đầu thoát ra ở cathode thì mất 2 giờ, khi đó khối lượng cathode tăng thêm 4,2 g
Sau 2h, ion kim loại a mol Ag+ và b mol Cu2+ bị điện phân hết, khối lượng cathode tăng = mAg + mCu = 108 a + 64 b = 4,2 g
Thời gian để điện phân hết a mol Ag+ và b mol Cu2+:
⇒ a = b = 0,02
Vậy nồng độ mol của Cu(NO3)2 trong dung dịch X là 0,03 M
Lời giải SBT Hóa 12 Bài 16: Điện phân hay khác:
Câu 16.19 trang 57 SBT Hóa học 12: Cho các cặp oxi hóa – khử và thế điện cực chuẩn tương ứng: ....
Câu 16.20 trang 57 SBT Hóa học 12: Cho các cặp oxi hóa – khử và thế điện cực chuẩn tương ứng: ....