Top 100 Đề thi Hoá học 11 Kết nối tri thức (có đáp án)
Haylamdo biên soạn và sưu tầm tuyển chọn 100 Đề thi Hoá học 11 Kết nối tri thức Học kì 1, Học kì 2 năm học 2024 mới nhất có đáp án và lời giải chi tiết, cực sát đề thi chính thức gồm đề thi giữa kì, đề thi học kì giúp học sinh lớp 11 ôn luyện và đạt điểm cao trong các bài thi Hoá học 11.
Đề thi Hoá học 11 có đáp án - Kết nối tri thức
Xem thử đề thi GK1 Hóa 11 Xem thử đề thi CK1 Hóa 11 Xem thử đề thi GK2 Hóa 11
Chỉ từ 50k mua trọn bộ Đề thi Hoá học 11 Kết nối tri thức bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
0711000255837- NGUYEN THANH TUYEN - Ngân hàng Vietcombank (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận đề thi
Đề thi Hoá học 11 Giữa kì 1 Kết nối tri thức
Đề thi Hoá học 11 Học kì 1 Kết nối tri thức
Đề thi Hoá học 11 Giữa kì 2 Kết nối tri thức
Đề thi Hoá học 11 Học kì 2 Kết nối tri thức
Sở Giáo dục và Đào tạo ...
Đề thi Giữa kì 1 - Kết nối tri thức
Năm học 2023 - 2024
Môn: Hoá học lớp 11
Thời gian làm bài: phút
(Đề số 1)
Phần I: Trắc nghiệm (7 điểm)
* Mức độ nhận biết
Câu 1. Nhận xét nào sau đây là đúng?
A. Trong phản ứng một chiều, chất sản phẩm có thể phản ứng với nhau để tạo thành chất đầu.
B. Trong phản ứng thuận nghịch, chất sản phẩm không thể phản ứng với nhau để tạo thành chất đầu.
C. Phản ứng một chiều là phản ứng luôn xảy ra không hoàn toàn.
D. Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều trái ngược nhau trong cùng một điều kiện.
Câu 2. Khi ở trạng thái cân bằng, nhận xét nào sau đây là đúng?
A. Tốc độ phản ứng thuận nhỏ hơn tốc độ phản ứng nghịch.
B. Các chất không phản ứng với nhau.
C. Nồng độ chất sản phẩm luôn lớn hơn nồng độ chất đầu.
D. Nồng độ các chất không thay đổi.
Câu 3. Sự điện li là
A. quá trình phân huỷ các chất thành chất mới khi hoà tan vào nước.
B. quá trình kết hợp giữa các ion thành phân tử trong dung dịch.
C. quá trình phản ứng giữa các ion tạo ra chất kết tủa.
D. quá trình phân li thành ion của các chất tan khi tan vào nước.
Câu 4. Chất nào sau đây không phải là chất điện li?
A. CuO.
B. NaCl.
C. CuCl2.
D. NaOH.
Câu 5. Giá trị pH của một dung dịch được tính theo biểu thức nào sau đây?
A. pH = −log[H+].
B. pH = 14 + log[H+].
C. pH = 14 −log[OH-].
D. pH = log[OH−]
Câu 6. Dịch vị dạ dày của người bình thường có pH trong khoảng 1,5 – 3,5. Môi trường của dịch vị dạ dày là
A. môi trường base.
B. môi trường acid.
C. môi trường trung tính.
D. môi trường trung hoà.
Câu 7. Theo thuyết acid – base của Bronsted – Lowry, base là
A. chất nhận electron.
B. chất cho electron.
C. chất nhận proton.
D. chất cho proton.
Câu 8. Trong tự nhiên, nguyên tố nitrogen (N) tồn tại ở dạng nào sau đây?
A. Tồn tại ở cả dạng đơn chất và dạng hợp chất.
B. Chỉ tồn tại ở dạng đơn chất.
C. Chỉ tồn tại ở dạng hợp chất hữu cơ.
D. Chỉ tồn tại ở dạng hợp chất vô cơ.
Câu 9. Đặc điểm cấu tạo của phân tử N2 là
A. có 1 liên kết ba.
B. có 1 liên kết đôi.
C. Có 2 liên kết đôi.
D. có 2 liên kết ba.
Câu 10. Dạng hình học của phân tử ammonia là
A. hình tam giác đều.
B. hình tứ diện đều.
C. đường thẳng.
D. hình chóp tam giác.
Câu 11. Cho vài giọt phenolphthalein vào dung dịch NH3 thì dung dịch chuyển thành
A. màu hồng.
B. màu vàng.
C. màu đỏ.
D. màu xanh.
Câu 12. Muối nào sau đây tan tốt trong nước?
A. CaCO3.
B. BaSO4.
C. NH4Cl.
D. AgCl.
Câu 13. Khi cho dung dịch NaOH vào dung dịch NH4Cl, đun nóng thì thấy thoát ra
A. một chất khí màu lục nhạt.
B. một chất khí không màu, mùi khai, làm xanh giấy quỳ tím ẩm.
C. một chất khí màu nâu đỏ, làm xanh giấy quỳ tím ẩm.
D. chất khí không màu, không mùi.
Câu 14. Nhóm các kim loại đều không phản ứng được với HNO3?
A. Al, Cu.
B. Au, Pt.
C. Mg, Au.
D. Ag, Pt.
Câu 15. HNO3 tinh khiết là chất lỏng không màu, nhưng dung dịch HNO3 để lâu thường chuyển sang màu vàng là do
A. HNO3 tan nhiều trong nước.
B. dung dịch HNO3 là acid mạnh.
C. dung dịch HNO3 có tính oxi hóa mạnh.
D. HNO3 tinh khiết kém bền, bị phân huỷ một phần giải phóng NO2.
Câu 16. Đặc điểm nào sau đây không phải là đặc điểm cấu tạo của phân tử nitric acid?
A. Nguyên tử nitrogen có số oxi hoá +5, là số oxi hoá cao nhất của nitrogen.
B. Liên kết O – H phân cực mạnh về phía nguyên tử oxygen.
C. Liên kết N → O là liên kết ion.
D. Liên kết N → O là liên kết cho – nhận.
* Mức độ thông hiểu
Câu 17. Biểu thức nào sau đây là biểu thức hằng số cân bằng (KC) của phản ứng:
C(S) + 2H2 (g) ⇌ CH4(g)?
A. KC = .
B. KC = .
C. KC = .
D. KC = .
Câu 18. Cho các cân bằng hoá học:
(1) N2(g) + 3H2(g) 2NH3(g)
(2) H2(g) + I2(g) 2HI(g)
(3) 2SO2(g) + O2(g) 2SO3(g)
(4) 2NO2(g) N2O4(g)
Khi thay đổi áp suất số cân bằng hóa học bị chuyển dịch là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 19. Cho cân bằng (trong bình kín) sau:
CO (g) + H2O (g) CO2 (g) + H2 (g); < 0.
Trong các yếu tố: (1) tăng nhiệt độ; (2) thêm một lượng hơi nước; (3) thêm một lượng H2; (4) tăng áp suất chung của hệ; (5) dùng chất xúc tác.
Dãy gồm các yếu tố đều làm thay đổi cân bằng của hệ là:
A. (1), (4), (5).
B. (1), (2), (3).
C. (2), (3), (4).
D. (1), (2), (4).
Câu 20. Phương trình điện li nào dưới đây viết không đúng?
A. HBR → H+ + Br−.
B. HCOOH HCOO− + H+.
C. Na2SO4 → Na+ + .
D. Na3PO4 → 3Na+ + .
Câu 21. Đối với dung dịch acid yếu CH3COOH 0,10 M, nếu bỏ qua sự điện li của nước thì đánh giá nào về nồng độ mol ion sau đây là đúng?
A. [H+] = 0,10 M.
B. [H+] < [CH3COO-].
C. [H+] > [CH3COO-].
D. [H+] < 0,10 M.
Câu 22. Cho phương trình: NH3 + H2O + OH−
Trong phản ứng nghịch, theo thuyết Bronsted – Lowry chất nào là base?
A. NH3.
B. H2O.
C.
D. OH−.
Câu 23. Khí nitrogen trơ về mặt hoá học ở điều kiện thường là do
A. Phân tử có liên kết ba, năng lượng liên kết lớn.
B. Phân tử có liên kết ba, năng lượng liên kết nhỏ.
C. Phân tử có liên kết đôi, năng lượng liên kết lớn.
D. Phân tử có liên kết đôi, năng lượng liên kết nhỏ.
Câu 24. Ở nhiệt độ cao, khí nitrogen phản ứng với khí hydrogen và khí oxygen theo hai phương trình hoá học sau:
N2 + 3H2 2NH3 (1);
N2 + O2 2NO (2)
Trong các phản ứng (1) và (2), vai trò của N2 lần lượt là
A. chất oxi hoá; chất khử.
B. chất khử; chất khử.
C. chất oxi hoá; chất oxi hoá.
D. chất khử; chất oxi hoá.
Câu 25. Cho các phát biểu sau:
(a) Trong không khí, N2 chiếm khoảng 78% về thể tích.
(b) Phân tử N2 có chứa liên kết ba bền vững nên N2 trơ về mặt hóa học ngay cả khi đun nóng.
(c) Trong phản ứng giữa N2 và H2 thì N2 vừa là chất oxi hóa, vừa là chất khử.
(d) N2 lỏng có nhiệt độ thấp nên thường được sử dụng để bảo quản thực phẩm.
(e) Phần lớn N2 được sử dụng để tổng hợp NH3 từ đó sản xuất nitric acid, phân bón, ...
Số phát biểu đúng là
A. 2.
B. 3.
C. 4.
D. 5.
Câu 26. Có thể nhận biết muối ammonium bằng cách cho muối tác dụng với dung dịch kiềm thấy thoát ra một chất khí. Chất khí đó là
A. NH3.
B. H2.
C. NO2
D. NO.
Câu 27. Phương trình hóa học nào sau đây sai?
A. NH4NH3 NH3 + HNO3.
B. NH4Cl NH3 + HCl.
C. (NH4)2CO3 2NH3 + CO2 + H2O.
D. NH4HCO3 NH3 + CO2 + H2O.
Câu 28. Cho sơ đồ phản ứng: Fe3O4 + HNO3 → Fe(NO3)3 + NO + H2O. Sau khi cân bằng, tổng hệ số cân bằng (nguyên, tối giản) của các chất trong phản ứng là
A. 55.
B. 20.
C. 25.
D. 50.
Phần II. Tự luận (3 điểm)
* Mức độ vận dụng – vận dụng cao
Câu 29 (1 điểm). Xét các hệ cân bằng sau trong một bình kín:
(1)
(2)
Các cân bằng trên chuyển dịch như thế nào (chiều thuận, chiều nghịch, không chuyển dịch) khi biến đổi các điều kiện sau:
|
Yếu tố biến đổi |
Cân bằng (1) |
Cân bằng (2) |
|
Tăng nhiệt độ |
|
|
|
Thêm một lượng hơi nước |
|
|
|
Thêm khí H2 |
|
|
|
Tăng áp suất chung của hệ |
|
|
|
Dùng chất xúc tác |
|
|
Câu 30 (1 điểm). Một loại sữa tắm có nồng độ ion OH− là mol/L
(a) Tính nồng độ ion H+, pH của loại sữa tắm nói trên.
(b) Môi trường của loại sữa tắm trên là acid, base hay trung tính?
Câu 31 (1 điểm). Biến thiên enthalpy chuẩn của phản ứng tổng hợp ammonia từ nitrogen và hydrogen có giá trị âm nhưng vì sao quá trình Haber lại chọn nhiệt độ phản ứng khá cao, vào khoảng 400 – 600 oC.
Sở Giáo dục và Đào tạo ...
Đề thi Học kì 1 - Kết nối tri thức
Năm học 2023 - 2024
Môn: Hoá học lớp 11
Thời gian làm bài: phút
(Đề số 1)
I. PHẦN TRẮC NGHIỆM (7,0 điểm)
Câu 1. Phản ứng nào sau đây là phản ứng thuận nghịch?
A. N2 + 3H2 ⇌ 2NH3.
B. Fe + 2HCl → FeCl2 + H2.
C. 2H2 + O2 ⟶ 2H2O.
D. 2KClO3 → 2KCl + 3O2.
Câu 2. Phát biểu nào sau đây về một phản ứng thuận nghịch tại trạng thái cân bằng là đúng?
A. Tốc độ của phản ứng thuận lớn hơn tốc độ của phản ứng nghịch.
B. Nồng độ của tất cả các chất trong hỗn hợp phản ứng là không đổi.
C. Nồng độ mol của chất phản ứng luôn bằng nồng độ mol của chất sản phẩm.
D. Phản ứng thuận và phản ứng nghịch đều dừng lại.
Câu 3. Trong các chất sau, chất không điện li là
A. KHCO3.
B. HCl.
C. KOH.
D. CH4.
Câu 4. Một dung dịch có nồng độ H+ bằng 0,01M thì pH và [OH−]của dung dịch này là
A. pH = 2; [OH-]=10-12 M.
B. pH = 2; [OH-]=10-10 M.
C. pH = 10-2; [OH-]=10-11 M.
D. pH = 2; [OH-]=10-11 M.
Câu 5. Trong không khí, chất nào sau đây chiếm phần trăm thể tích lớn nhất?
A. O2.
B. NO.
C. CO2.
D. N2.
Câu 6. Trong các phát biểu sau, phát biểu nào không đúng?
A. NH3 là chất khí không màu, không mùi, tan ít trong nước.
B. Khí NH3 nặng hơn không khí.
C. Khí NH3 dễ hoá lỏng, tan nhiều trong nước.
D. Phân tử NH3 chứa các liên kết cộng hoá trị phân cực.
Câu 7. Thành phần chính của quặng pyrite là
A. FeS.
B. FeS2.
C. CaSO4.
D. BaSO4.
Câu 8. Tính chất nào sau đây là tính chất vật lí của sulfur?
A. Chất khí, không màu.
B. Chất rắn, màu nâu đỏ.
C. Không tan trong benzene.
D. Không tan trong nước.
Câu 9. Bước sơ cứu đầu tiên cần làm ngay khi một người sulfuric acid đậm đặc đổ vào tay gây bỏng là
A. rửa với nước lạnh nhiều lần.
B. trung hoà acid bằng NaHCO3.
C. băng bó tạm thời vết bỏng.
D. đưa đến cơ sở y tế gần nhất.
Câu 10. Chất nào sau đây được dùng để bổ sung khoáng chất cho phân bón, thức ăn gia súc …?
A. BaSO4.
B. CaSO4.
C. MgSO4.
D. NH4SO4.
Câu 11. Hoá học hữu cơ là ngành hoá học chuyên nghiên cứu về
A. hợp chất của carbon.
B. hydrocarbon.
C. dẫn xuất hydrocarbon.
D. hợp chất hữu cơ.
Câu 12. Trong thành phần phân tử hợp chất hữu cơ nhất định phải có nguyên tố nào sau đây?
A. Hydrogen.
B. Carbon.
C. Carbon, hydrogen và oxygen.
D. Oxygen.
Câu 13. Để tách dầu ăn ra khỏi hỗn hợp dầu ăn và nước nên sử dụng phương pháp tách chất nào sau đây?
A. Phương pháp chưng cất.
B. Phương pháp chiết.
C. Phương pháp kết tinh.
D. Sắc kí cột.
Câu 14. Phương pháp chưng cất thường được dùng để tách riêng từng chất trong hỗn hợp nào sau đây?
A. Nước và dầu ăn.
B. Bột mì và nước.
C. Cát và nước.
D. Nước và rượu.
Câu 15. Hydrocarbon là hợp chất hữu cơ có thành phần nguyên tố gồm
A. carbon và hydrogen.
B. hydrogen và oxygen.
C. carbon và oxygen.
D. carbon và nitrogen.
Câu 16. Cặp chất nào sau đây cùng dãy đồng đẳng?
A. CH4 và C2H4.
B. CH4 và C2H6.
C. C2H4 và C3H4.
D. C2H2 và C4H4.
Câu 17. Cho cân bằng hoá học sau:
H2(g) + I2(g) ⇌ 2HI(g)
Biểu thức hằng số cân bằng của phản ứng trên là
A. KC = .
B. KC = .
C. KC = .
D. KC = .
Câu 18. Cho phản ứng thuận nghịch sau:
Trong phản ứng thuận, chất đóng vai trò là base theo thuyết Bronsted – Lowry là
A. .
B. H2O.
C. .
D. OH−.
Câu 19. Ammonia tan nhiều trong nước là do
A. phân tử có liên kết cộng hoá trị không cực.
B. có khả năng tạo liên kết hydrogen với nước.
C. phân tử có liên kết ion.
D. NH3 là một chất khí, mùi khai.
Câu 20. Trong khí quyển, khi có sấm sét nitrogen bị oxi hóa để tạo thành oxide của nitrogen. Oxide được tạo thành bởi quá trình này có công thức là
A. NO.
B. N2O5.
C. N2O.
D. N2O4.
Câu 21. Dãy gồm các kim loại không tác dụng với dung dịch HNO3 đặc, nguội là
A. Zn, Cu, Au, Pt.
B. Al, Fe, Au, Pt.
C. Mg, Cu, Au, Pt.
D. Mg, Ag, Au, Pt.
Câu 22. Cho phản ứng hoá học sau:
SO2 + 2H2S → 3S + 2H2O
Vai trò của của SO2 trong phản ứng trên là
A. chất khử.
B. acid.
C. base.
D. chất oxi hoá.
Câu 23. Cho kim loại Cu tác dụng với acid H2SO4 đặc, nóng. Khí sinh ra có tên gọi là
A. khí oxygen.
B. khí hydrogen.
C. khí carbonic.
D. khí sulfur dioxide.
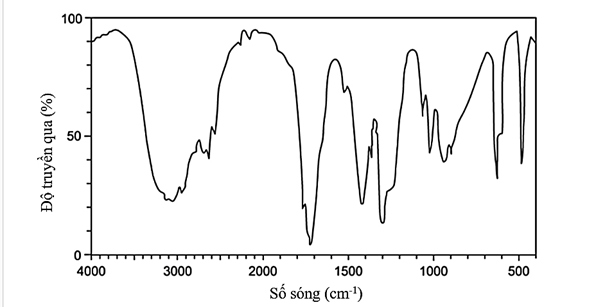
Câu 24. Cho phổ hồng ngoại của chất X như hình dưới đây:
Phân tử chất X có chứa nhóm chức?
A. – CHO.
B. – COOH.
C. – OH.
D. –NH2.
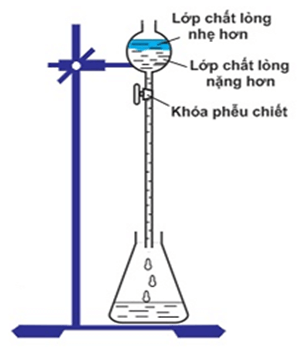
Câu 25. Cho hình vẽ mô tả quá trình chiết hai chất lỏng không trộn lẫn vào nhau:
Phát biểu nào sau đây là sai?
A. Chất lỏng nhẹ hơn sẽ nổi lên trên trên phễu chiết.
B. Chất lỏng nhẹ hơn sẽ được chiết trước.
C. Chất lỏng nặng hơn sẽ ở phía dưới đáy phễu chiết.
D. Chất lỏng nặng hơn sẽ được chiết trước.
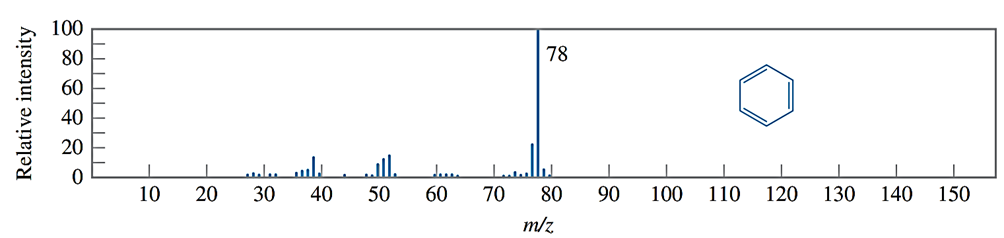
Câu 26. Phổ khối lượng của hợp chất hữu cơ X được cho như hình vẽ bên dưới:
Phân tử khối của hợp chất hữu cơ X là
A. 80.
B. 78.
C. 76.
D. 50.
Câu 27. Công thức hoá học nào sau đây không phù hợp với thuyết cấu tạo hoá học?
A. CH3 – CH2 – OH.
B. CH3–O=CH–CH3.
C. CH3 – CH2 – CH2 – NH2.
D. CH3Cl.
Câu 28. Cặp chất nào sau đây là đồng phân của nhau?
A. CH3C6H4Cl và C6H5Cl.
B. CH3OH và CH3CH2OH.
C. CH3OCH3 và CH3 CH2OH.
D. C6H5OH và C2H5OH.
II. PHẦN TỰ LUẬN. (3,0 điểm)
Câu 29. Kết quả phân tích nguyên tố cho thấy thành phần phần trăm khối lượng các nguyên tố có trong hợp chất X như sau: carbon là 52,17%; hydrogen là 13,04%; còn lại là oxygen.
Biết phân tử khối của X là 46. Xác định công thức phân tử của hợp chất X.
Câu 30. Viết đồng phân cấu tạo mạch carbon hở của hợp chất hữu cơ có công thức phân tử: C4H10O.
Câu 31. Sulfur dioxide là chất khí, không màu, có mùi hắc, độc,… Đặc biệt, khí sulfur dioxide là một trong những tác nhân gây mưa acid. Hãy đề xuất các biện pháp nhằm giảm lượng khí sulfur dioxide thải vào bầu khí quyển?
Sở Giáo dục và Đào tạo ...
Đề thi Giữa kì 2 - Kết nối tri thức
Năm học 2023 - 2024
Môn: Hoá học lớp 11
Thời gian làm bài: phút
(Đề số 1)
I. PHẦN TRẮC NGHIỆM (7,0 điểm)
Câu 1: Pentane là tên theo danh pháp thay thế của
A. CH3[CH2]2CH3.
B. CH3[CH2]3CH3.
C. CH3[CH2]4CH3.
D. CH3[CH2]5CH3.
Câu 2: Alkane hòa tan tốt trong dung môi nào sau đây?
A. Nước.
B. Benzene.
C. Dung dịch acid HCl.
D. Dung dịch NaOH.
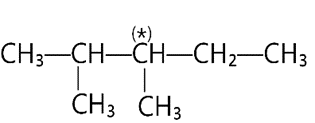
Câu 3: Bậc của nguyên tử carbon đánh dấu (*) trong hợp chất sau là
A. bậc I.
B. bậc II.
C. bậc III.
D. bậc IV.
Câu 4: Phương pháp nào sau đây có thể được thực hiện để góp phần hạn chế ô nhiễm môi trường do các phương tiện giao thông gây ra?
A. Không sử dụng phương tiện giao thông.
B. Cấm các phương tiện giao thông tại các đô thị.
C. Sử dụng phương tiện chạy bằng điện hoặc nhiên liệu xanh.
D. Sử dụng các phương tiện chạy bằng than đá.
Câu 5: Alkyne là những hydrocarbon có đặc điểm
A. không no, mạch hở, có một liên kết ba C≡C.
B. không no, mạch vòng, có một liên kết đôi C=C.
C. không no, mạch hở, có một liên kết đôi C=C.
D. không no, mạch hở, có hai liên kết ba C≡C.
Câu 6: Alkene là các hydrocarbon không no, mạch hở, có công thức chung là
A. CnH2n+2 (n ≥ 1).
B. CnH2n (n ≥ 2).
C. CnH2n (n ≥ 3).
D. CnH2n-2 (n ≥ 2).
Câu 7: Alkyne CH3-C≡C-CH3 có tên gọi là
A. but-1-yne.
B. but-2-yne.
C. methylpropyne.
D. meylbut-1-yne.
Câu 8: Khi có mặt chất xúc tác Ni ở nhiệt độ thích hợp, alkene cộng hydrogen vào liên kết đôi tạo thành hợp chất nào dưới đây?
A. Alkane.
B. Cycloalkane.
C. Alkyne.
D. Alkene lớn hơn.
Câu 9: Ở điều kiện thường, chất nào sau đây làm mất màu dung dịch Br2?
A. Benzene.
B. Ethylene.
C. Methane.
D. Butane.
Câu 10: Công thức phân tử nào sau đây có thể là công thức của hợp chất thuộc dãy đồng đẳng của benzene?
A. C8H16.
B. C8H14.
C. C8H12.
D. C8H10.
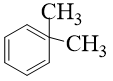
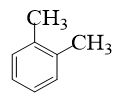
Câu 11: Hợp chất nào sau đây không tồn tại?
A.
B.
C.
D.
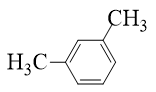
Câu 12: Hợp chất nào sau đây là m-xylene?
A.
B.
C.
D.
Câu 13: Chất nào sau đây có thể làm nhạt màu dung dịch Br2 trong CCl4 ở điều kiện thường?
A. Benzene.
B. Toluene.
C. Styrene.
D. Naphthalene.
Câu 14: Công thức tổng quát của dẫn xuất monochlorine no, mạch hở là:
A. CnH2n-5Cl.
B. CnH2n-3Cl.
C. CnH2n-1Cl.
D. CnH2n+1Cl.
Câu 15: Tên gốc – chức của dẫn xuất halogen có công thức cấu tạo C2H5Cl là
A. methyl chloride.
B. phenyl chloride.
C. ethyl chloride.
D. propyl chloride.
Câu 16: Cho phản ứng hóa học sau:
Phản ứng trên thuộc loại phản ứng nào sau đây?
A. Phản ứng thế.
B. Phản ứng cộng.
C. Phản ứng tách.
D. Phản ứng oxi hóa – khử.
Câu 17: Cho các alkane kèm theo nhiệt độ nóng chảy và nhiệt độ sôi (°C) sau: propane (-187,7 và - 42,1), butane (-138,3 và - 0,5), pentane (-129,7 và 36,1), hexane (- 95,3 và 68,7). Số alkane tồn tại ở thể khí ở điều kiện thường là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 18: Cho các chất sau: chloromethane, dichloromethane, trichloromethane và tetrachloromethane. Số chất là sản phẩm của phản ứng xảy ra khi trộn methane với chlorine và chiếu ánh sáng tử ngoại là
A. 1.
B. 2.
C. 3.
D. 4
Câu 19: Khi cho 2,2-dimethylpropane phản ứng với chlorine (tỉ lệ mol 1:1), chiếu sáng thì có thể tạo ra tối đa bao nhiêu sản phẩm thế monochloro?
A. 1.
B. 2.
C. 3.
D. 5.
Câu 20: Số lượng đồng phân cấu tạo mạch hở ứng với công thức phân tử C4H8 là
A. 2.
B. 3.
C. 4.
D. 5.
Câu 21: Số liên kết δ và liên kết π trong phân tử vinylacetylene: CH≡C–CH=CH2 lần lượt là
A. 7 và 2.
B. 7 và 3.
C. 3 và 3.
D. 3 và 2.
Câu 22: Chất nào sau đây không có đồng phân hình học?
A. CH3-CH=CH-CH3.
B. (CH3)2C=CH-CH3.
C. CH3-CH=CH-CH(CH3)2.
D. (CH3)2CH-CH=CH-CH(CH3)2.
Câu 23: Cho các hydrocarbon: (1) CH2=C(CH3)CH2CH3; (2) (CH3)2C=CHCH3; (3) CH2=C(CH3)CH=CH2; (4) (CH3)2CHC≡CH. Những hydrocarbon nào phản ứng với HBr sinh ra sản phẩm chính là 2-bromo-2-methylbutane?
A. (1) và (2).
B. (2) và (4).
C. (1) và (3).
D. (3) và (4).
Câu 24: Số đồng phân hydrocarbon thơm ứng với công thức phân tử C8H10 là
A. 2.
B. 4.
C. 3.
D. 5.
Câu 25: A là đồng đẳng của benzene có công thức thực nghiệm là: (C3H4)n (n ∈ N*). Công thức phân tử của A là
A. C3H4.
B. C6H8.
C. C9H12.
D. C12H16.
Câu 26: Cho sơ đồ phản ứng sau: C6H5-CH2CH3
X và Y đều là các sản phẩm hữu cơ. Công thức cấu tạo thu gọn của X, Y lần lượt là
A. C6H5-COOH, C6H5-COOK.
B. C6H5-CH2COOK, C6H5-CH2COOH.
C. C6H5-COOK, C6H5-COOH.
D. C6H5-CH2COOH, C6H5-CH2COOK.
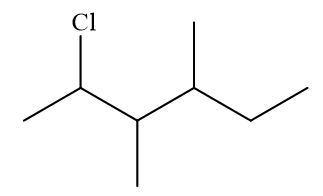
Câu 27: Cho dẫn xuất halogen có công thức cấu tạo sau:
Danh pháp thay thế của dẫn xuất halogen trên là
A. 3,4-dimethyl-2-chlorohexane.
B. 2-chloro-3,4-dimethylhexane.
C. 3,4-dimethyl-5-chlorohexane.
D. 5-chloro-3,4-dimethylhexane.
Câu 28: Sản phẩm chính của phản ứng nào sau đây không đúng?
A. CH3CH(Cl)CH3 + NaOH CH3CH(OH)CH3 + NaCl
B. CH3CH2Cl + KOH CH2 = CH2 + KCl + H2O
C. CH3Br + KOH CH3OH + KBr
D. CH3CH2CH(Br)CH3 + KOH CH3CH = CHCH3 + KBr + H2O
II. PHẦN TỰ LUẬN (3 điểm)
Câu 29 (1 điểm):
a. Viết công thức cấu tạo và gọi tên các alkane có công thức phân tử C5H12?
b. Cho 2-methylpropane tác dụng với chlorine (tỉ lệ mol 1 :1, có ánh sáng) thu được tối đa bao nhiêu sản phẩm thế monochloro?
Câu 30 (1 điểm):
a. Cục Quản Lí Thực Phẩm và Dược Phẩm Hoa Kì (FDA) đã công nhận ethylene là an toàn trong việc kích thích trái cây mau chín. Tuy nhiên khi vượt quá nồng độ cho phép, ví dụ đối với nồng độ 27 000 ppm, tức gấp khoảng 200 lần mức cần thiết để kích thích quá trình chín, một tia lửa điện có thể đốt cháy ethylene và gây ra vụ nổ chết người.
Trong phòng ủ chín, ethylene được sử dụng ở nồng độ 100 ppm – 150 ppm. Khối lượng ethylene cần thiết sử dụng để phòng ủ chín có thể tích 50 m3 đạt nồng độ 140 ppm ở 25 °C và 1 bar là bao nhiêu? (Biết: 1ppm = 1/1000000).
b. Viết công thức cấu tạo của sản phẩm chính tạo thành trong các phản ứng dưới đây:
(1) CH ≡ CH + 2H2
(2) CH3 – C ≡ CH + 2HBr ⟶
(3) CH ≡ CH + 2Br2 ⟶
Câu 31 (1 điểm): Cho biết thành phần thuốc bảo vệ thực vật thường dùng ở Việt Nam. Các thuốc này có nguồn gốc hoá học hay sinh học? Lựa chọn và sử dụng các loại thuốc bảo vệ thực vật như thế nào để bảo đảm an toàn, hiệu quả?