Cho hỗn hợp gồm Fe và FeS tác dụng với dung dịch HCl dư, thu được 2,464 lít hỗn hợp khí
Bài 32: Hiđro sunfua - Lưu huỳnh đioxit - Lưu huỳnh trioxit
Bài 8 trang 139 Hóa 10: Cho hỗn hợp gồm Fe và FeS tác dụng với dung dịch HCl (dư), thu được 2,464 lít hỗn hợp khí (đktc). Cho hỗn hợp khí này đi qua dung dịch Pb(NO3)2 (dư) thu được 23,9 gam kết tủa màu đen.
a) Viết các phương trình phản ứng.
b) Hỗn hợp khí thu được gồm những khí nào ? Thể tích mỗi khí là bao nhiêu (đktc) ?
c) Tính khối lượng của Fe và Fe trong hỗn hợp ban đầu.
Trả lời
n hh khí = 2,464/22,4 = 0,11 mol ;
nPbS = 23,9/239 = 0,1 mol
a) Phương trình hóa học của phản ứng.
Fe + 2HCl → FeCl2 + H2 ↑
x mol x mol.
FeS + 2HCl → FeCl2 + H2S ↑
y mol y mol
H2S + Pb(NO3)2 → PbS ↓ + 2HNO3
0,01 ← 0,1 mol
b) Hỗn hợp khí thu được là H2 và H2S
Theo phương trình phản ứng hóa học trên ta có:
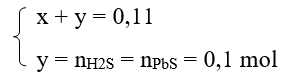
→ x = 0,01 mol
V H2 = 0,01.22,4 = 0,224 lít; VH2S = 22,4.0,1 = 2,24 l
c) mFe = 56. 0,01 = 0,56g ; mFeS = 0,1.88 = 8,8g.

