Bài 32.13, 32.14, 32.15, 32.16, 32.17, 32.18, 32.19, 32.20, 32.21, 32.22 trang 42 SBT Hóa học 9
Bài 32.13, 32.14, 32.15, 32.16, 32.17, 32.18, 32.19, 32.20, 32.21, 32.22 trang 42 SBT Hóa học 9
Bài 32.13 trang 42 Sách bài tập Hóa học 9: Cho 23,6 gam hỗn hợp gồm Mg, Fe, Cu tác dụng vừa hết với 91,25 gam dung dịch HCl 20% thu được dung dịch A và 12,8 gam chất không tan.
Tính khối lượng các kim loại trong hỗn hợp ban đầu.
Lời giải:
Cu không tác dụng với dung dịch HCl nên 12,8 gam là khối lượng của Cu.
nHCl = 91,25x20/(100x36,5) = 0,5 mol
Phương trình hóa học:
Mg + 2HCl → MgCl2 + H2
Fe + 2HCl → FeCl2 + H2
nMg = x
nFe = y
Ta có các phương trình:
24x + 56y = 23,6 - 12,8 = 10,8 (I)
2x + 2y = 0,5 (II)
Giải phương trình (I), (II) ta tìm được x và y:
x = 0,1; y = 0,15; mMg = 2,4g; mFe = 8,4g
Bài 32.14 trang 42 Sách bài tập Hóa học 9: Nguyên tố A tạo được 2 loại oxit. Phần trăm về khối lượng của oxi trong 2 oxit lần lượt bằng 50% và 60%. Xác định nguyên tử khối của A và cho biết công thức 2 oxit trên.
Lời giải:
Gọi công thức 2 oxit là A2Ox và A2Oy, đồng thời kí hiệu A là nguyên tử khối. Ta có tỉ lệ khối lượng oxi trong 2 oxit là : 50% và 60%. Vậy tỉ lệ khối lượng A trong 2 oxit là 50% và 40%.
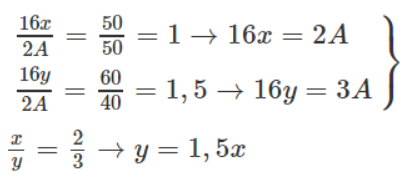
Chỉ có các cặp x, y sau có thể chấp nhận :
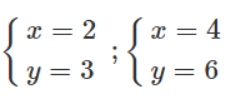
- Nếu chọn x = 2 → ta có 32 = 2A → A = 16 (loại) vì A = 16 là oxi.
- Nếu chọn x = 4 → ta có 64 = 2A → A = 32 → A là lưu huỳnh (S).
Tỉ lệ giữa các nguyên tố là tối giản, ta có hai oxit là : SO2 và SO2
Bài 32.15 trang 42 Sách bài tập Hóa học 9: Cho 8 gam một oxit (có công thức XO3) tác dụng với dung dịch NaOH dư tạo ra 14,2 gam muối khan.Tính nguyên tử khối của X.
Lời giải:
Gọi nguyên tử khối của nguyên tố X cũng là X.
Phương trình hoá học :
XO3 + 2NaOH → Na2XO4 + H2O
(X + 48) gam (46 + X + 64) gam
8 gam 14,2 gam
8(46 +X + 64)= 14,2(X + 48)
Giải ra ta có X = 32. Nguyên tố X là lưu huỳnh (S).
Bài 32.16 trang 42 Sách bài tập Hóa học 9: Hai nguyên tố X và Y ở hai chu kì kế tiếp nhau trong bảng tuần hoàn các nguyên tố hoá học và có tổng số điện tích hạt nhân là 16.
a) Xác định tên các nguyên tố X và Y
b) Cho biết vị trí của 2 nguyên tố trong bảng tuần hoàn.
Lời giải:
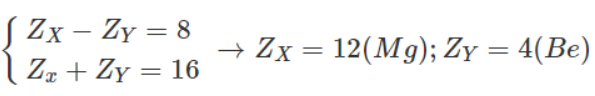
Tên nguyên tố X là magie, nguyên tố Y là beri.
b) Nguyên tố Mg ở chu kì 3 nhóm IIA.
Nguyên tố Be ở chu kì 2 nhóm IIA.
Bài 32.17 trang 42 Sách bài tập Hóa học 9: Xác định thành phần phần trăm (về thể tích) của hỗn hợp khí gồm N2, CO và CO2, biết rằng khi cho 10,0 lít (ở đktc) hỗn hợp khí đó đi qua một lượng dư nước vôi, rồi cho qua đồng(II) oxit dư đốt nóng thì thu được 5 gam kết tủa và 3,2 gam đồng.
Nếu cũng lấy 10,0 lít (ở đktc) hỗn hợp khí đó cho đi qua ống đồng(II) oxit dư đốt nóng, rồi đi qua một lượng dư nước vôi trong thì thu được bao nhiêu gam kết tủa ?
Lời giải:
Phương trình hóa học của phản ứng:
CO2 + Ca(OH)2 → CaCO3 + H2O
CuO + CO to CO2 + Cu
nCaCO3 = 5/100 = 0,05 mol
nCu = 3,2/64 = 0,05 mol
Như vậy: nhh = 10/22,4 = 0,45 mol; nN2 = 0,45 - 0,05 - 0,05 = 0,35 mol
%VN2 = 0,35/0,45 x 100% = 77,78%
%VCO2 = %VCO = 0,05/0,45 x 100% = 11,11%
Nếu cho phản ứng (2) thực hiện trước rồi mới đến phản ứng (1) thì
∑nCO2 = 0,05 + 0,05 = 0,1 mol
nCaCO3 = 0,1 mol
Vậy mCaCO3 = 0,1 x 100 = 10g
Bài 32.18 trang 42 Sách bài tập Hóa học 9: Hoà tan 10 gam hỗn hợp 2 muối cacbonat của kịm loại hoá trị II và III bằng dung dịch HCl, ta thu được dung dịch X và 0,672 lít khí bay ra (ở đktc). Tính khối lượng muối thu được khi cô cạn dung dịch X.
Lời giải:
Áp dụng phương pháp tăng giảm khối lượng
Viết phương trình hoá học của XCO3 và Y2(CO3)3 với dung dịch HCl, ta nhận thấy khi chuyển từ muối cacbonat thành muối clorua thì cứ 1 mol CO2 bay ra thì khối lượng tăng : 71 - 60 = 11 (gam)
0,O3 mol CO2 bay ra thì khối lượng tăng : 0,O3 x 11 gam
Tổng khối lượng muối clorua tạo thành : 10 + (0,O3 x 11)= 10,33 (gam)
Bài 32.19 trang 42 Sách bài tập Hóa học 9: Thể tích khí clo cần phản ứng với kim loại M bằng 1,5 lần lượng khí sinh ra khi cho cùng lượng kim loại đó tác dụng hoàn toàn với dung dịch axit HCl dư trong cùng điều kiện. Khối lượng muối clorua sinh ra trong phản ứng với clo gấp 1,2886 lần lượng sinh ra trong phản ứng với axit HCl. Xác định kim loại M
Lời giải:
Phương trình hóa học của phản ứng:
M + n/2HCl → MCln
M + mHCl → MClm + m/2H2
Theo đề bài, ta có:
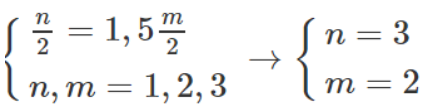
và M + 106,5 = 1,2886 (M+71)
Giải ra, ta có M = 52 (Cr)
Bài 32.20 trang 42 Sách bài tập Hóa học 9: X, Y là hai nguyên tố halogen thuộc hai chu kì liên tiếp trong bảng tuần hoàn. Hỗn hợp A chứa 2 muối X, Y với natri. Để kết tủa hoàn toàn 2,2 gam hỗn hợp A phải dùng 150 ml dung dịch AgNO3 0,2M. Xác định hai nguyên tố X và Y.
Lời giải:
NaX + AgNO3 → NaNO3 + AgX
a mol a mol a mol a mol
NaY + AgNO3 → NaNO3+ AgY
b mol b moi b mol b mol
nAgNO3 = 0,2 x 150/1000 = 0,O3 mol
mAgNO3 = 0,3 x 170 = 5,1g
nNaNO3 = 0,O3 => mNaNO3 = 0,O3 x 85 = 2,55g
Áp dụng định luật bảo toàn khối lượng, ta có :
2,2 + 5,1 = 2,55 + mkết tủa → mkết tủa = 4,75 (gam)
(108 + X)a + (108 + Y)b = 4,75 ; a + b = 0,O3 (mol)
Xa + Yb + 15,1. Cho X > Y ; Xa + Xb > Xa + Yb > Ya + Yb
X > 1,51/0,O3 > Y > X > 50,3 > Y
X và Y là các halogen liên tiếp, vậy đó là brom (80) và Cl (35,5).
Bài 32.21 trang 42 Sách bài tập Hóa học 9: Cho 8,3 gam hỗn hợp hai kim loại đệu có hoá trị III là X và Y (có tỉ lệ số mol là 1:1) tác dụng vừa đủ với 6,72 lít khí clo. Sau đó hoà tan toàn bộ muối tạo ra trong nước (dư) được 250 ml dung dịch. Xác định hai kim loại và nồng độ mol mỗi muối trong dung dịch thu được.
Lời giải:
Kí hiệu X,Y cũng là nguyên tử khối của 2 kim loại, số mol của 2 kim loại là a
2X + 3Cl2 to 2XCl3
a mol 3a/2 mol a mol
2Y + 3Cl2 to 2YCl3
a mol 3a/2 mol a mol
Theo phương trình hóa học trên và dữ liệu đề bài, ta có :
3a/2 + 3a/2 = 6,72/22,4 = 0,3 mol => a = 0,1 mol
Xa + Ya = 8,3 → 0,1(X + Y) = 8,3 → X + Y = 83
Vậy X = 56 (Fe) và Y = 27 (Al)
CM (AlCl3) = CM (FeCl3) = 0,1/0,25 = 0,4M
Bài 32.22 trang 42 Sách bài tập Hóa học 9: Đem nung 6,7 gam hỗn hợp 2 muối CaCO3 và XCO3 có tỉ lệ số mol là 1:2 đến khối lượng không đổi, thấy khối lượng chất rắn giảm đi 3,3 gam. Dẫn toàn bộ lượng khí sinh ra qua bình đựng 2,5 lít dung dịch nước vôi trong 0,O2M.
a) Xác định kim loại X
b) Tính nồng độ mol của các chất trong dung dịch khi cho CO2 vào nước vôi trong.
Lời giải:
a) Khối lượng chất rắn giảm đi là khối lượng khí CO2 bay ra
nCO2 = 3,3/44 = 0,075 mol
Phương trình hoá học của phản ứng:
CaCO3 to CaO + CO2
a mol a mol
XCO3 to XO + CO2
2a mol 2a mol
Theo phương trình hoá học trên và dữ kiện đề bài, ta có :
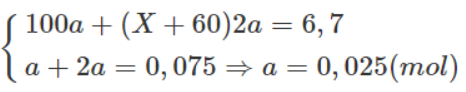
Giải hệ phương trình trên ta thu được : X = 24 (Mg).
b) nCa(OH)2 = 0,O2 x 2,5 = 0,05 mol
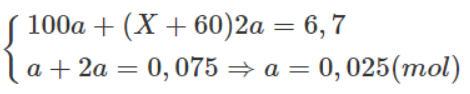
Như vậy tạo thành 2 muối : CaCO3 và Ca(CO3)2
CO2 + Ca(0H)2 → CaCO3 + H20
0,05 0,05 0,05 (mol)
Số mol CO2 dư : 0,075 - 0,05 = 0,O25 (mol) nên có phản ứng
CO2 + CaCO3 + H20 → Ca(HCO3)2
0,O25 0,O25 0,O25 (mol)
Dung dịch thu được có 0,O25 mol Ca(HCO3)2
CM (Ca(HCO3)2) = 0,O25/0,25 = 0,01M

