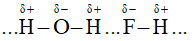Giải Hóa 10 Kết nối tri thức Bài 14: Ôn tập chương 3 - Kết nối tri thức
Haylamdo biên soạn và sưu tầm lời giải bài tập Hóa 10 Bài 14: Ôn tập chương 3 Kết nối tri thức hay, có đán án chi tiết, bám sát chương trình mới sgk Hóa học 10 hy vọng sẽ giúp các bạn dễ dàng làm bài tập Hóa học 10 Bài 14.
Giải bài tập Hóa lớp 10 Bài 14: Ôn tập chương 3
I. Hệ thống hóa kiến thức
Hoàn thành sơ đồ hệ thống hóa kiến thức trang 68 Hóa học 10:
Liên kết hóa học gồm:
- Liên kết cộng hóa trị
+ Khái niệm: là liên kết hóa học được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron chung.
+ Kiểu liên kết: không phân cực, phân cực và cho nhận.
• Không phân cực: cặp electron dùng chung nằm chính giữa hai nguyên tử.
Ví dụ: Cl2, Br2, …
• Có phân cực: cặp electron dùng chung lệch về nguyên tử có độ âm điện lớn hơn.
Ví dụ: H2O, CO, NH3, …
• Cho nhận: cặp electron dùng chung là do một nguyên tử đóng góp.
Ví dụ: SO2, HNO3, …
- Liên kết ion
+ Khái niệm: là liên kết hóa học được hình thành giữa hai ion mang điện tích trái dấu (tồn tại trong khối tinh thể)
Ví dụ: NaCl, NaF, CaCl2, …
+ Tinh thể ion: Các ion âm và dương sắp xếp tại các nút của mạng tinh thể theo trật tự luân phiên, liên kết bằng lực hút tĩnh điện của chúng.
- Liên kết hydrogen và tương tác van der waals
+ Khái niệm: đều là liên kết giữa các phân tử (hay nguyên tử) trung hòa hút nhau bởi bản chất tĩnh điện giữa các lưỡng cực δ+ và δ-.
+ Liên kết hydrogen:
+ Tương tác Van der waals:
+ Ảnh hưởng: đều làm tăng nhiệt độ sôi, nhiệt độ nóng chảy của các chất.
II. Luyện tập (trang 69)