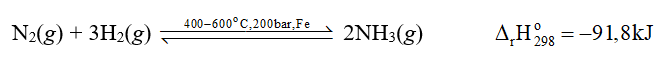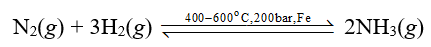Giải Hóa học 11 trang 38 Cánh diều
Haylamdo biên soạn và sưu tầm với Giải Hóa 11 trang 38 trong Bài 5: Một số hợp chất quan trọng của nitrogen Hóa học lớp 11 Cánh diều hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời các câu hỏi & làm bài tập Hóa học 11 trang 38.
Giải Hóa học 11 trang 38 Cánh diều
Bài tập 1 trang 38 Hoá học 11: Vì sao nói ammonia có vai trò rất quan trọng đối với nông nghiệp? Cho ví dụ minh hoạ.
Lời giải:
Gần đây, mỗi năm có khoảng hàng trăm triệu tấn ammonia được sản xuất trên toàn cầu. Trong đó, có khoảng 80% được sử dụng để sản xuất phân đạm ammonium, urea … để cung cấp nguyên tố nitrogen cho đất và cây trồng. Ví dụ phản ứng dưới đây dùng để tổng hợp ra phân bón với thành phần chính là ammonium sulfate:
2NH3(aq) + H2SO4(aq) → (NH4)2SO4(aq)
Vì thế có thể nói ammonia có vai trò rất quan trọng đối với nông nghiệp.
Bài tập 2 trang 38 Hoá học 11: Biến thiên enthalpy chuẩn của phản ứng tổng hợp ammonia từ nitrogen và hydrogen có giá trị âm nhưng vì sao quá trình Haber lại chọn nhiệt độ phản ứng khá cao, vào khoảng 400 oC – 600 oC?
Lời giải:
phản ứng thuận toả nhiệt. Tuy nhiên, khi thực hiện phản ứng ở nhiệt độ quá thấp thì tốc độ của phản ứng nhỏ, phản ứng diễn ra chậm. Thực tế, người ta đã chọn nhiệt độ phù hợp, khoảng 400 oC – 600 oC.
Bài tập 3 trang 38 Hoá học 11: Ở 472 °C, hằng số cân bằng của phản ứng tổng hợp ammonia từ nitrogen và hydrogen theo quá trình Haber là K = 0,105. Giả sử, kết quả phân tích cho thấy tại thời điểm cân bằng, nồng độ của nitrogen và hydrogen trong buồng phản ứng lần lượt là 0,0201 M và 0,0602 M.
a) Hãy tính nồng độ mol của ammonia có trong buồng phản ứng tại thời điểm cân bằng.
b) Làm thế nào để tách được ammonia ra khỏi hỗn hợp?
Lời giải:
Ban đầu: a b 0 M
Phản ứng: x 3x 2x M
Cân bằng: 0,0201 0,0602 2x M
Áp dụng công thức có:
b) Tại thời điểm cân bằng, nồng độ ammonia, nitrogen và hydrogen trong buồng phản ứng là không đổi. Khi đó hỗn hợp khí này được dẫn qua hệ thống làm lạnh để hoá lỏng ammonia và tách ra khỏi hỗn hợp.
Bài tập 4 trang 38 Hoá học 11: Quá trình đốt cháy nhiên liệu trong ô tô sinh ra nhiều khí như SO2, CO, NO. Từ năm 1975, người ta thiết kế “bộ chuyển đổi xúc tác” trong hệ thống xả khí của ô tô (và cả trong máy phát điện) nhằm tạo điều kiện thuận lợi cho phản ứng:
2CO(g) + 2NO(g) → 2CO2(g) +N2(g)
a) Cho biết ý nghĩa của phản ứng trên đối với môi trường.
b) Trong phản ứng trên, chất nào là chất oxi hoá, chất nào là chất khử? Giải thích.
c) Giá trị enthalpy tạo thành chuẩn của CO(g), NO(g), CO2(g) lần lượt là –110,5; 91,3; –393,5 (kJ mol-1). Hãy tính biến thiên enthalpy chuẩn của phản ứng trên. Phản ứng trên có thuận lợi về mặt năng lượng không? Giải thích.
Lời giải:
a) Ý nghĩa của phản ứng: 2CO(g) + 2NO(g) → 2CO2(g) + N2(g) đối với môi trường là giảm khí độc CO, giảm tác nhân gây mưa acid NO phát sinh từ quá trình đốt cháy nhiên liệu.
b)
Số oxi hoá của carbon tăng từ +2 lên +4 sau phản ứng nên CO đóng vai trò là chất khử.
Số oxi hoá của nitrogen giảm từ +2 xuống 0 sau phản ứng nên NO đóng vai trò là chất oxi hoá.
c)
= 2. (-393,5) + 0 – 2.(-110,5) – 2.91,3 = -748,6 (kJ) < 0.
Vậy phản ứng này toả nhiệt, thuận lợi về mặt năng lượng.
Bài tập 5 trang 38 Hoá học 11: Viết sơ đồ phản ứng gây ra mưa chứa nitric acid và sulfuric acid.
Lời giải:
- Sơ đồ phản ứng gây ra mưa chứa nitric acid:
Các phương trình hoá học minh hoạ cho sơ đồ:
N2(g) + O2(g) 2NO(g)
2NO(g) + O2(g) → 2NO2(g)
4NO2(g) + 2H2O(l) + O2(g) → 4HNO3(aq)
HNO3 → H+ + NO3-
- Sơ đồ phản ứng gây ra mưa chứa sulfuric acid:
Các phương trình hoá học minh hoạ cho sơ đồ:
SO2 + H2O → H2SO3
SO3 + H2O → H2SO4.
Bài tập 6 trang 38 Hoá học 11: Hãy tìm hiểu, chỉ ra các hoạt động tạo thành các khí gây mưa acid tại địa phương em. Đề xuất một số biện pháp giảm thiểu sự tạo thành các khí đó.
Lời giải:
- Một số hoạt động tạo thành các khí gây mưa acid tại địa phương em: khí thải của phương tiện giao thông; khí thải của nhà máy chưa qua xử lí ra môi trường; khí thải do đốt rác, đốt than …
- Một số biện pháp giảm thiểu sự tạo thành các khí này:
+ Tăng cường sử dụng xe đạp, phương tiện công cộng thay cho các phương tiện động cơ cá nhân như ô tô, xe máy …
+ Tăng cường sử dụng các nguồn năng lượng mới, năng lượng sạch, năng lượng tái tạo;
+ Sử dụng tiết kiệm, hiệu quả nguồn tài nguyên thiên nhiên;
+ Cải tiến công nghệ sản xuất, có biện pháp xử lí khí thải và tái chế các sản phẩm phụ có chứa sulfur.
Lời giải bài tập Hóa học 11 Bài 5: Một số hợp chất quan trọng của nitrogen hay khác: