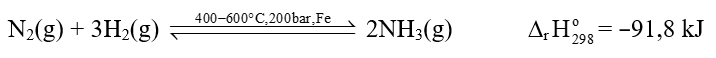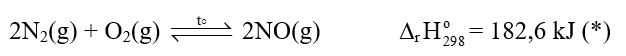Lý thuyết Hóa học 11 Cánh diều Bài 4: Đơn chất nitrogen
Haylamdo biên soạn và sưu tầm với tóm tắt lý thuyết Hóa 11 Bài 4: Đơn chất nitrogen sách Cánh diều hay nhất, chi tiết sẽ giúp học sinh lớp 11 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 11.
Lý thuyết Hóa 11 Cánh diều Bài 4: Đơn chất nitrogen
I. Trạng thái tự nhiên của nitrogen
- Nguyên tố nitrogen có kí hiệu hóa học là N, số hiệu nguyên tử là 7, độ âm điện là 3,04.
- Trong tự nhiên, nitrogen tồn tại ở cả dạng đơn chất và hợp chất.
+ Trong khí quyển, nguyên tố nitrogen tồn tại chủ yếu dưới dạng đơn chất N2. Khí nitrogen chiếm khoảng 78% thể tích không khí.
+ Trong đất và nước, nguyên tố nitrogen tồn tại chủ yếu dưới dạng ion nitrate (), nitrite () và ammonium ().
+ Nguyên tố nitrogen có trong cơ thể mọi sinh vật, chủ yếu ở các dạng hợp chất hữu cơ như amino acid, nucleic acid, chlorophyll (chất diệp lục)… Các chất này đóng vai trò quan trọng trong quá trình sinh hoá của sinh vật.
II. Đơn chất nitrogen
1. Đặc điểm liên kết
- Phân tử N2 có liên kết ba giữa 2 nguyên tử nitrogen, cả hai nguyên tử này đều thỏa mãn quy tắc octet với công thức Lewis như sau:
2. Tính chất cơ bản
a) Tính kém hoạt động (tính trơ) ở nhiệt độ thấp.
- Liên kết ba giữa hai nguyên tử N trong phân tử nitrogen có năng lượng liên kết rất lớn (946 kJ mol-1) nên rất khó bị phá vỡ. Vì vậy, ở nhiệt độ và áp suất thường nitrogen rất khó tham gia các phản ứng hóa học. Đặc điểm này gọi là tính kém hoạt động hóa học hay tính trơ của đơn chất nitrogen.
b) Tính hoạt động hóa học ở nhiệt độ cao.
- Phản ứng của nitrogen và hydrogen diễn ra thuận nghịch., được thực hiện ở điều kiện nhiệt độ và áp suất cao cùng với chất xúc tác là bột sắt.
Nitrogen phản ứng với oxygen ở nhiệt độ rất cao, khoảng 3000◦C, tạo ra nitrogen monoxide (NO).
Trong khí quyển, phản ứng này chính là sự khởi đầu cho quá trình tạo ion nitrate, được coi là một nguồn cung cấp đạm cho đất. Cụ thể:
+ Trước tiên, nitrogen monoxide được tạo thành từ nitrogen và oxygen khi có sấm sét (phản ứng (*)).
+ Sau đó, nitrogen monoxide nhanh chóng bị oxi hóa bởi oxygen trong khí quyển tạo thành nitrogen dioxide (NO2)
2NO(g) + O2(g) → 2NO2(g) ∆r= −116,2 kJ
+ Tiếp theo là quá trình nitrogen dioxide chuyển hóa thành acid trong nước mưa:
4NO2(g) + 2H2O(l) + O2(g) → 4HNO3(aq)
Nước mưa có nồng độ acid phù hợp sẽ cung cấp đạm cho đất ở dạng ion nitrate cần thiết cho cây trồng.
3. Ứng dụng
- Mỗi năm có hàng trăm triệu tấn nitrogen được sản xuất trên toàn cầu, trong đó lượng nitrogen dạng khí chiếm khoảng 2/3, còn lại là nitrogen dạng lỏng.
- Khí nitrogen được dùng để thay thế hoàn toàn hoặc một phần không khí để giảm nguy cơ cháy nổ, giảm quá trình oxi hóa do oxygen trong không khí gây nên.
- Nitrogen lỏng được sử dụng để làm lạnh nhanh, bảo quản thực phẩm ngay tại nhà máy và trong quá trình vận chuyển. Nitrogen lỏng còn được sử dụng để đóng băng và kiểm soát dòng chảy trong các đường ống.
- Trong lĩnh vực sinh học và y học, bình nitrogen lỏng được sử dụng để bảo quản các mẫu vật sinh học (máu, mô, tế bào, bộ phận cơ thể…).
Do có nhiệt độ rất thấp, nitrogen lỏng có thể gây bỏng lạnh khi tiếp xúc trực tiếp trên da nên làm việc với nitrogen lỏng cần tuyệt đối cẩn thận và áp dụng các biện pháp bảo hộ an toàn.