Cho hỗn hợp FeS và Fe tác dụng với dung dịch HCl dư, thu được 2,464 lít hỗn hợp khí ở điều kiện tiêu chuẩn
Hóa lớp 10 Bài 44: Hiđro sunfua
Bài 5 (trang 177 sgk Hóa 10 nâng cao): Cho hỗn hợp FeS và Fe tác dụng với dung dịch HCl (dư), thu được 2,464 lít hỗn hợp khí ở điều kiện tiêu chuẩn. Dẫn hỗn hợp khí này đi qua dung dịch Pb(NO3)2 (dư), sinh ra 23,9g kết tủa màu đen.
a) Viết phương trình hóa học của các phản ứng đã xảy ra.
b) Hỗn hợp khí thu được gồm những khí nào? Tính tỉ lệ số mol các khí trong hỗn hợp.
c) Tính thành phần phần trăm theo khối lượng của hỗn hợp rắn ban đầu.
Lời giải:
a) Các phản ứng xảy ra:
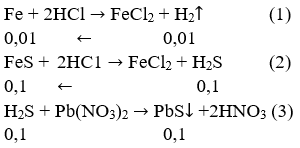
b) Hỗn hợp khí gồm H2 và khí H2S
Số mol PbS:
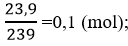
Số mol H2Svà H2:
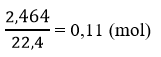
Số mol H2 : 0,11 - 0,1 = 0,01 (mol).
Tỉ lệ số mol 2 khí:
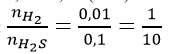
c)Theo các phản ứng (1) và (2) ta có:
nFe = nH2 = 0,01 mol ⇒ mFe = 0,01.56 = 0,56(g)
nFeS = nH2S = 0,1 mol ⇒ mFeS = 0,1.88 = 8,8(g)
Vậy: %mFe = [0,56/(0,56 + 8,8)]. 100% = 5,98%; %mFeS = 94,02%

