Cân bằng sau tồn tại trong dung dịch: CH3COOH ↔ H+ + CH3COO-
Bài 2: Phân loại các chất điện li
Bài 7 (trang 10 sgk Hóa 11 nâng cao): Cân bằng sau tồn tại trong dung dịch: CH3COOH ↔ H+ + CH3COO-
Độ điện li α của CH3COOH sẽ biến đổi như thế nào?
a) Khi nhỏ vào vài giọt dung dịch HCl.
b) Khi pha loãng dung dịch.
c) Khi nhỏ vào vài giọt dung dịch NaOH.
Lời giải:
Xét cân bằng: CH3COOH ↔ H+ + CH3COO-
a) Khi thêm HCl nồng độ [H+] tăng ⇒ cân bằng dịch chuyển theo chiều nghịch tạo CH3COOH ⇒ số mol H+ và CH3COO- điện li ra ít ⇒ α giảm.
b) Khi pha loãng dung dịch, các ion dương và ion âm ở cách xa nhau hơn ít có điều kiện để va chạm vào nhau để tạo lại phân tử ⇒ α tăng.
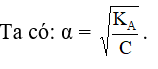
Như vậy, V tăng ⇒ C = n/V giảm và KA không đổi
⇒ KA/C tăng ⇒ α tăng.
c) Khi nhỏ vào vài giọt dung dịch NaOH, ion OH- điện li ra từ NaOH sẽ lấy H+ :
H+ + OH- → H2O, làm nồng độ H+ gảm ⇒ cân bằng dịch chuyển theo chiều thuận ⇒ số mol H+ và CH3COO- điện li ra nhiều ⇒ α tăng.

