Giải Hóa học 11 nâng cao Chương 2: Nhóm Nitơ
Giải Hóa học 11 nâng cao Chương 2: Nhóm Nitơ
Haylamdo biên soạn và sưu tầm lời giải bài tập Hóa học 11 nâng cao Chương 2: Nhóm Nitơ hay, chi tiết được biên soạn bám sát nội dung sách giáo khoa Hóa học lớp 11 nâng cao giúp bạn biết cách làm bài tập Hóa học 11.

- Bài 9: Khái quát về nhóm nitơ
- Bài 10: Nitơ
- Bài 11: Amoniac và muối amoni
- Bài 12: Axit nitric và muối nitrat
- Bài 13: Luyện tập Tính chất của nitơ và hợp chất của nitơ
- Bài 14: Photpho
- Bài 15: Axit photphoric và muối photphat
- Bài 16: Phân bón hóa học
- Bài 17: Luyện tập tính chất của photpho và các hợp chất của photpho
- Bài 18: Thực hành tính chất của một số hợp chất nitơ, photpho. Phân biệt một số loại phân bón
Giải Hóa 11 nâng cao Bài 9: Khái quát về nhóm nitơ
Bài 1 (trang 36 sgk Hóa 11 nâng cao): Viết cấu hình electron nguyên tử của các nguyên tố asen, antimon và bitmut ở trạng thái cơ bản và trạng thái kích thích.
Lời giải:
- Cấu hình electron của As ( Z = 33) : [Ar] 3d104s24p3
Ở trạng thái kích thích: [Ar] 3d104s14p3d1
- Cấu hình electron của Sb ( Z = 51): [Kr]4d105s25p3
Ở trạng thái kích thích: [Kr]4d105s15p35d1
- Cấu hình electron của Bi ( Z = 83): [Xe]4f145d106s26p3
Ở trạng thái kích thích: [Xe]4f145d106s16p36d1
Bài 2 (trang 36 sgk Hóa 11 nâng cao): Dựa vào độ âm điện của các nguyên tố, giải thích:
a) Tại sao từ nitơ đến bitmut tính phi kim của các nguyên tố giảm dần?
b) Tại sao tính phi kim của nitơ yếu hơn so với oxi và càng yếu hơn so với flo?v
Lời giải:
a) Trong nhóm VA đi từ N đến Bi độ âm điện giảm ⇒ Tính phi kim giảm vì độ âm điện đặc trưng cho tính phi kim.
b) Các nguyên tố N, O và F thuộc chu kì 2 của bảng tuần hoàn. Theo quy luật của một chu kì, theo chiều tăng của điện tích hạt nhân độ âm điện tăng, tính phi kim tăng.
Vì vậy tính phi kim: 7N < 8O < 9F.
Bài 3 (trang 36 sgk Hóa 11 nâng cao): Nêu một số hợp chất trong đố nitơ và photpho có số oxi hóa -3, +3, +5.
Lời giải:
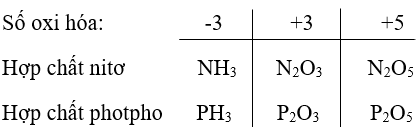
Bài 4 (trang 36 sgk Hóa 11 nâng cao): Tại sao trong các hợp chất nitơ chỉ có hóa trị tối đa là 4, trong khi đối với các nguyên tố còn lại hóa trị tối đa của chúng là 5?
Lời giải:
Nguyên tử nitơ không có obitan d trống, nên ở rạng thái kích thích không xuất hiện 5 electron độc thân để tạo thành 5 liên kết cộng hóa trị. Ngoài khả năng tạo 3 liên kết cộng hóa trị bằng sự góp chung electron, nitơ còn có khả năng tạo thêm 1 liên kết cho – nhận. Các nguyên tố còn lại của nhóm VA khi ở trạng thái kích thích nguyên tử của chúng xuất hiện 5 electron độc thân nên có khả năng tạo 5 liên kết cộng hóa trị.
Bài 5 (trang 36 sgk Hóa 11 nâng cao): Lập các phương trình hóa học sau và cho biết As, Bi và Sb2O3 thể hiện tính chất gì?
a) As + HNO3 → H3ASO4 + H2O
b) Bi + HNO3 → Bi(NO3)3+ NO + H2O
c) Sb2O3 + HCl → SbCl3 + H2O
d) Sb2O3 + NaOH → NaSbO2 + H2O
Lời giải:
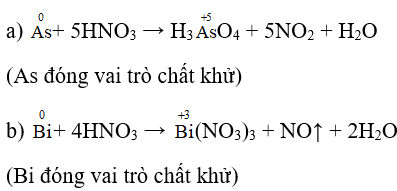
c) Sb2O3 + 6HCl → 2SbCl3 + 3H2O (Sb2O3 đóng vai trò bazơ)
d) Sb2O3 + 2NaOH → 2NaSbO2 + H2O (Sb2O3 đóng vai trò axit)
Vậy Sb2O3 là hợp chất lưỡng tính.

