Hoà tan 12,8 g kim loại hoá trị II trong một lượng vừa đủ dung dịch HNO3 60,0% (D = 1,365 g/ml)
Bài 13: Luyện tập: Tính chất của nitơ, photpho và các hợp chất của chúng
Giải bài 4 trang 20 SBT Hóa 11 Bài 13: Luyện tập: Tính chất của nitơ, photpho và các hợp chất của chúng giúp học sinh biết cách làm bài tập trong SBT Hóa 11.
Bài 13.4 trang 20 Sách bài tập Hóa học 11: Hoà tan 12,8 g kim loại hoá trị II trong một lượng vừa đủ dung dịch HNO3 60,0% (D = 1,365 g/ml), thu được 8,96 lít (đktc) một khí duy nhất màu nâu đỏ. Tên của kim loại và thể tích dung dịch HNO3 đã phản ứng là
A. đồng; 61,5 ml.
B. chì; 65,1 ml.
C. thuỷ ngân; 125,6 ml.
D. sắt; 82,3 ml.
Lời giải:
Đáp án: A.
Phương trình hóa học:
M + 4HNO3 → M(NO3)2 + 2NO2↑ + 2H2O (màu nâu đỏ)
Số mol khí NO2:
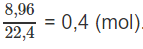
Theo phương trình hoá học :
nM = 0,2 mol và
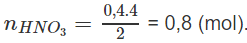
Khối lượng mol nguyên tử của kim loại M :
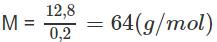
⇒ kim loại là Cu (đồng).
Gọi V (ml) là thể tích của dung dịch HNO3 60,0%. Ta có phương trình liên hệ V với nHNO3:
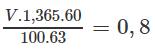
⇒ V = 61,5 ml

