Một mẫu nước chứa Pb(NO3)2. Để xác định hàm lượng Pb2+, người ta hoà tan một lượng dư Na2SO4
Bài 4: Phản ứng trao đổi ion trong dung dịch các chất điện li
Giải bài 8 trang 7 SBT Hóa 11 Bài 4: Phản ứng trao đổi ion trong dung dịch các chất điện li giúp học sinh biết cách làm bài tập trong SBT Hóa 11.
Bài 4.8 trang 7 Sách bài tập Hóa học 11: Một mẫu nước chứa Pb(NO3)2. Để xác định hàm lượng Pb2+, người ta hoà tan một lượng dư Na2SO4 vào 500 ml nước đó. Làm khô kết tủa sau phản ứng thu được 0,96 g PbSO4. Hỏi nước này có bị nhiễm độc chì không, biết rằng nồng độ chì tối đa cho phép trong nước sinh hoạt là 0,1 mg/l?
Lời giải:
Pb(NO3)2 + Na2SO4 → PbSO4↓ + 2NaNO3
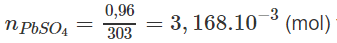
tạo thành trong 500 ml = Số mol Pb(NO3)2 trong 500 ml.
Lượng PbSO4 hay Pb2+ có trong 1 lít nước :
3,168.10-3.2 = 6,336.10-3 (mol).
Số gam chì có trong 1 lít:
6,336.10-3.207 = 1,312 (g/l) hay 1,312 mg/ml.
Vậy nước này bị nhiễm độc chì.

