Bài 22.1, 22.2, 22.3 trang 29 SBT Hóa học 8
Bài 22.1, 22.2, 22.3 trang 29 SBT Hóa học 8
Bài 22.1 trang 29 sách bài tập Hóa 8: Đốt cháy 3,25g một mẫu lưu huỳnh không tinh khiết trong không khí có oxi dư, người ta thu được 2,24 lit khí sunfuro(dktc).
a) Viết phương trình hóa học xảy ra.
b) Bằng cách nào ta có thể tính được nồng độ tinh khiết của mẫu lưu huỳnh đã dùng?
c) Căn cứ vào phương trình hóa học trên, ta có thể trả lời ngay được thể tích khí oxi (đktc) vừa đủ để đốt cháy lưu huỳnh là bao nhiêu lít?
Lời giải:
a) Phương trình hóa học: S + O2 → SO2
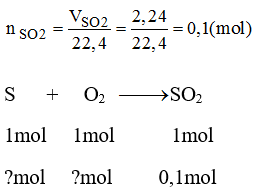
Theo pt: 1 mol S tham gia phản ứng sinh ra 1 mol SO2
Số mol của lưu huỳnh tham gia phản ứng:
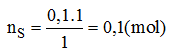
Khối lượng của lưu huỳnh tinh khiết: mS = nS.MS = 0,1.32 = 3,2(g)
Độ tinh khiết của mẫu lưu huỳnh:
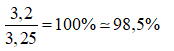
c) Theo pt 1 mol O2 phản ứng sinh ra 1 mol SO2
Tỉ lệ thể tích cũng chính là tỉ lệ về số mol nên thể tích O2 thu được 2,24 lít
Bài 22.2 trang 29 sách bài tập Hóa 8: Trong phòng thí nghiệm người ta có thể điều chế oxi bằng cách đốt nóng kali clorat:

Hãy dùng phương trình hóa học trên nên trả lời những câu hỏi sau:
a) Muốn điều chế được 4,48 lit khí oxi (đktc) cần dùng bao nhiêu gam KClO3 ?
b) Nếu có 1,5 mol KClO3 tham gia phản ứng, sẽ được bao nhiêu gam khí oxi?
c) Nếu có 0,1 mol KClO3 tham gia phản ứng, sẽ được bao nhiêu mol chất rắn và chất khí?
Lời giải:
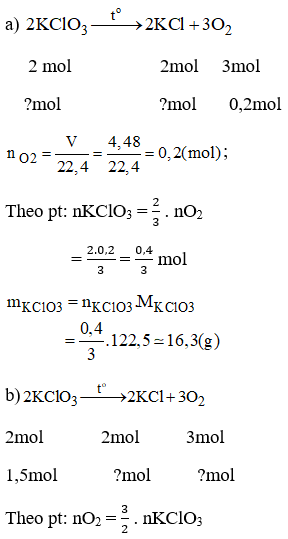
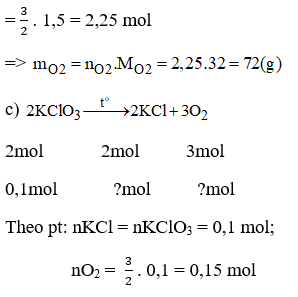
Bài 22.3 trang 29 sách bài tập Hóa 8: Cho khí hidro dư đi qua đồng (II) oxit nóng màu đen, người ta thu được 0,32g kim loại đồng màu đỏ và hơi nước ngưng tụ.
a) Viết phương trình hóa học xảy ra.
b) Tính lượng đồng (II) oxit tham gia phản ứng.
c) Tính thể tích khí hidro ở đktc đã tham gia phản ứng.
d) Tính lượng nước ngưng tụ thu được sau phản ứng.
Lời giải:
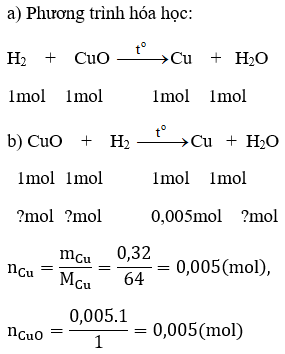
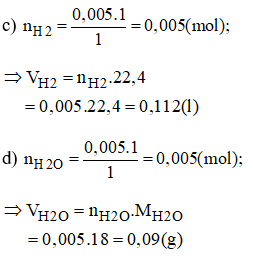
Chú ý: có thể tính mH2O theo định luật bảo toàn khối lượng:
(mH2O = (mCuO + mH2) - mCu)

