Bài 44.5, 44.6, 44.7 trang 61 SBT Hóa học 8
Bài 44.5, 44.6, 44.7 trang 61 SBT Hóa học 8
Bài 44.5 trang 61 sách bài tập Hóa 8: Hãy tính toán và trình bày cách pha chế 0,5lit dung dịch H2SO4 có nồng độ 1mol/l từ H2SO4 có nồng độ 98%, khối lượng riêng là 1,84g/ml.
Lời giải:
* Số mol của H2SO4 cần để pha chế 500ml dung dịch H2SO4 1M:
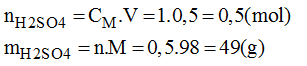
* Khối lượng H2SO4 98% có chứa 49g H2SO4:
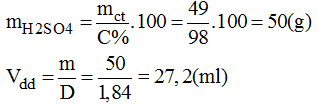
* Cách pha chế: Đổ khoảng 400ml nước cất vào cốc có chia độ có dung tích khoảng 1lit. Rót từ từ 27,2ml H2SO4 98% vào cốc khuấy đều. Sau đó thêm dần dần nước cất vào cốc cho đủ 500ml. ta pha chế được 500ml dung dịch H2SO4 1M.
Bài 44.6 trang 61 sách bài tập Hóa 8: A là dung dịch H2SO4 có nồng độ 0,2M. B là dung dịch H2SO4 có nồng độ 0,5M.
a) Nếu trộn A và B theo tỉ lệ thể tích VA:VB = 2:3 được dung dịch C. Hãy xác định nồng độ mol của dung dịch C.
b) Phải trộn A và B theo tỉ lệ nào về thể tích để được dung dịch H2SO4 có nồng độ 0,3M.
Lời giải:
a) Ta có: VA : VB = 2:3
Số mol H2SO4 có trong 2V (l) dung dịch A:
nH2SO4 = CM .VA = 0,2 . 2V = 0,4V (mol)
Số mol H2SO4 có trong 3V (l) dung dịch B:
nH2SO4 = CM .VB = 0,5 . 3V = 1,5V (mol)
Nồng độ mol của dung dịch H2SO4 sau khi pha trộn:
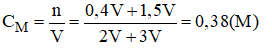
Vậy nồng độ mol của dung dịch C là 0,38M.
b) Pha chế dung dịch H2SO4 0,3M.
Gọi x(l) là thể tích của dung dịch axit A.
y(l) là thể tích của dung dịch B.
nH2SO4 (A) = CM .VA = 0,2 . x (mol)
nH2SO4 (B) = CM .VA = 0,5 . y (mol)
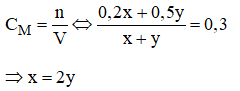
Vậy: ta phải trộn 2 thể tích dung dịch axit A với 1 thể tích dung dịch axit B, ta sẽ được dung dịch H2SO4 có CM = 0,3M.
Bài 44.7 trang 61 sách bài tập Hóa 8: Có 200g dung dịch NaOH 5% (dung dịch A).
a) Cần phải trộn thêm vào dung dịch A bao nhiêu gam dung dịch NaOH 10% để được dung dịch NaOH 8%?
b) Cần hòa tan bao nhiêu gam NaOH vào dung dịch A để có dung dịch A để có dung dịch NaOH 8%?
c) Làm bay hơi nước dung dịch A, người ta cũng thu được dung dịch NaOH 8%. Tính khối lượng nước đã bay hơi.
Lời giải:
a) Khối lượng NaOH có trong dung dịch ban đầu:
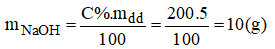
Gọi x(g) là khối lượng dung dịch NaOH 10% cần dùng:
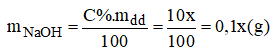
Đề thu được dung dịch 8% ta có:
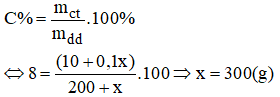
Vậy phải trộn thêm 300g dung dịch NaOH 10% ta sẽ có 500(g) dung dịch NaOH nồng độ 8%.
b) Gọi lượng NaOH cần hòa tan vào dd A là x (g)
Ta có công thức :
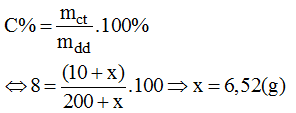
Vậy phải trộn thêm 6,52g NaOH vào dung dịch A để được dung dịch A để được dung dịch NaOH 8%.
c) Gọi x(g) là khối lượng của nước bay hơi khỏi dung dịch để có dung dịch NaOH 8%.
Ta có công thức:
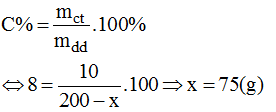
Vậy cho 75g nước bay hơi ra khỏi 200g dung dịch NaOH ban đầu, ta có: 200 – 75 = 125(g) dung dịch NaOH 8%.

