Bài 43.8, 43.9 trang 60 SBT Hóa học 8
Bài 43.8, 43.9 trang 60 SBT Hóa học 8
Bài 43.8 trang 60 sách bài tập Hóa 8: Có 2 lọ đựng dung dịch H2SO4. Lọ thứ nhất có nồng độ 1mol/l, lọ thứ hai có nồng độ 3 mol/l. Hãy tính toán và trình bày cách pha chế 50ml dung dịch H2SO4 có nồng độ 1,5mol/l từ 2 dung dịch axit đã cho.
Lời giải:
a) Pha chế 50ml dung dịch H2SO4 1,5M.
- Số mol H2SO4 cần pha chế 50ml dung dịch H2SO4 1,5M:
nH2SO4 = CM.V = 1,5.0,05 = 0,075 (mol)
Gọi x(ml) là thể tích của dung dịch H2SO4 1M (1)
Gọi y(ml) là thể tích của dung dịch H2SO4 3M (2)
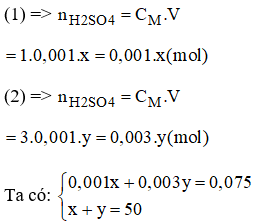
Giải hệ phương trình ta có: x = 37,5ml; y = 12,5ml
- Cách pha chế:
+ Đong lấy 37,5ml dung dịch H2SO4 1M và 12,5ml dung dịch H2SO4 3M cho vào bình, lắc đều, ta được 50ml dung dịch H2SO4 1,5M.
Bài 43.9 trang 60 sách bài tập Hóa 8: Cần dùng bao nhiêu ml dung dịch NaOH 3% có khối lượng riêng là 1,05g/ml và bao nhiêu mililit dung dịch NaOH 10% có khối lượng riêng là 1,12g/ml để pha chế được 2 lit dung dịch NaOH 8% có khối lượng riêng là 1,10g/ml.
Lời giải:
* Phần tính toán:
Khối lượng dung dịch NaOH: mdd = D.V = 1,1.2000=2200(g)
Khối lượng NaOH có trong 2 lit dung dịch:
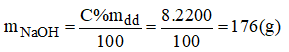
Gọi x(ml) là thể tích của dung dịch NaOH 3% ⇒ mdd = V.d = 1,05.x
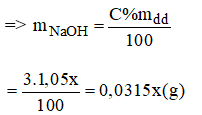
Gọi y(ml) là thể tích của dung dịch NaOH 10% ⇒ mdd = V.d = 1,12.y
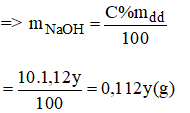
Ta có hệ phương trình sau:
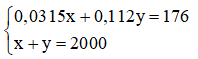
Giải hệ phương trình trên, ta được:
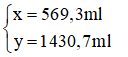
* Cách pha chế:
Đong lấy 569,3ml dung dịch NaOH 3% và 1430,7ml dung dịch NaOH 10% vào bình có dung dịch khoảng 3 lit. Trộn đều ta được 2 lit dung dịch NaOH 8% có khối lượng riêng 1,1g/ml.

