Đem nung 6,7 gam hỗn hợp 2 muối CaCO3 và XCO3 có tỉ lệ số mol là 1:2 đến khối lượng không đổi
Sách bài tập Hóa lớp 9 Bài 32: Luyện tập chương 3: Phi kim - Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Giải bài 22 trang 42 SBT Hóa học 9 Bài 32: Luyện tập chương 3: Phi kim - Sơ lược về bảng tuần hoàn các nguyên tố hóa học giúp học sinh biết cách làm bài tập Hóa 9.
Bài 32.22 trang 42 Sách bài tập Hóa học 9: Đem nung 6,7 gam hỗn hợp 2 muối CaCO3 và XCO3 có tỉ lệ số mol là 1:2 đến khối lượng không đổi, thấy khối lượng chất rắn giảm đi 3,3 gam. Dẫn toàn bộ lượng khí sinh ra qua bình đựng 2,5 lít dung dịch nước vôi trong 0,O2M.
a) Xác định kim loại X
b) Tính nồng độ mol của các chất trong dung dịch khi cho CO2 vào nước vôi trong.
Lời giải:
a) Khối lượng chất rắn giảm đi là khối lượng khí CO2 bay ra
nCO2 = 3,3/44 = 0,075 mol
Phương trình hoá học của phản ứng:
CaCO3 to CaO + CO2
a mol a mol
XCO3 to XO + CO2
2a mol 2a mol
Theo phương trình hoá học trên và dữ kiện đề bài, ta có :
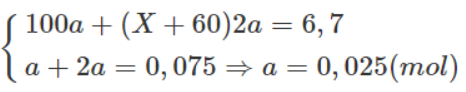
Giải hệ phương trình trên ta thu được : X = 24 (Mg).
b) nCa(OH)2 = 0,O2 x 2,5 = 0,05 mol
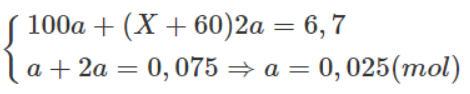
Như vậy tạo thành 2 muối : CaCO3 và Ca(CO3)2
CO2 + Ca(0H)2 → CaCO3 + H20
0,05 0,05 0,05 (mol)
Số mol CO2 dư : 0,075 - 0,05 = 0,O25 (mol) nên có phản ứng
CO2 + CaCO3 + H20 → Ca(HCO3)2
0,O25 0,O25 0,O25 (mol)
Dung dịch thu được có 0,O25 mol Ca(HCO3)2
CM (Ca(HCO3)2) = 0,O25/0,25 = 0,01M

