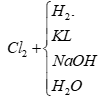Giáo án Hóa học 9 Bài 32: Luyện tập chương 3: Phi kim - Sơ lược về bảng tuần hoàn các nguyên tố hóa học mới nhất
Giáo án Hóa học 9 Bài 32: Luyện tập chương 3: Phi kim - Sơ lược về bảng tuần hoàn các nguyên tố hóa học mới nhất
I. Mục tiêu:
1) Kiến thức: HS nắm được các kiến thức sau :
*HS ôn tập , hệ thống lại các kiến thức cơ bản của phi kim và bản tuần hoàn , so sánh được tính chất cơ bản của Clo và Cacbon và so sánh với tính chất chung của phi kim .
*Biết vận dụng kiến thức cơ bản của bảng tuần hoàn để dự đoán tính chất hóa học của 1 số nguyên tố cơ bản .
2) Kĩ năng: HS biết
- Biết vận dụng kiến thức để làm các bài tập định tính và định lượng .
3)Thái độ:
- Ham mê hóa học và khoa học, tích cực học tập và giải quyết vấn đề
4) Phát triển năng lực
- Năng lực tự học và giải quyết vấn đề
- Năng lực sử dụng ngôn ngữ hóa học
- Năng lực giao tiếp và làm việc cá nhân, làm việc nhóm
II. Chuẩn bị:
Bảng tuần hoàn các nguyên tố hoá học
III. Tiến trình lên lớp:
1) ổn định:
2) Bài cũ:
3) Bài mới:
-Giới thiệu bài: chúng ta đã học chương III về phi kim và sơ lược về hệ thống tuần hoàn các nguyên tố hoá học. Chúng ta sẽ hệ thống lại những kiến thức quan trọng trong chương và vận dụng chúng.
-Các hoạt động dạy và học:
Hoạt động 1: I/Các kiến thức cần nhớ về phi kim
| Giáo viên | Học sinh | Nội dung ghi bài |
|---|---|---|
-GV sử dụng bảng tuần hoàn khái quát vị trí, số lượng các nguyên tố phi kim trong bảng -GV yêu cầu HS nghiên cứu sơ đồ 1 sgk trang 102 và nêu tính chất hoá học của phi kim -GV bổ sung và kết luận -GV yêu cầu HS nghiên cứu sơ đồ 2 sgk trang 102 và nêu tính chất hoá học của clo -GV bổ sung và kết luận -GV yêu cầu HS quan sát sơ đồ 3 sgk trang103 và nêu tính chất của C và hợp chất của C -GV bổ sung và kết luận Chú ý :có thể nội dung bài ghi GV chuẩn bị ở bảng phụ và được trình bày sau khi HS đã trả lời nội dung của từng sơ đồ -Gv yêu cầu HS dùng bảng tuần hoàn để nêu cấu tạo bảng tuần hoàn -GV bổ sung và kết luận -GV yêu cầu HS nêu sự biến đổi tính chất của các nguyên tố trong 1chu kì và trong 1 nhóm -GV bổ sung và kết luận -GV yêu cầu HS nêu ý nghĩa của bảng tuần hoàn -GV bổ sung và kết luận |
-HS dựa vào bảng tuần hoàn vừa quan sát vừa lắng nghe -HS quan sát sơ đồ 1sgk ,dựa vào kiến thức đã học thảo luận và trình bày khái quát(PK+ kim loại, PK+ H2,PK+ O2) -HS làm theo yêu cầu của GV là nêu tính chất hoá học của clo (Cl2+ H2O, Cl2 + H2, Cl2 + Kim loại, Cl2 + dd NaOH) -HS làm theo yêu cầu của GV, nêu tính chất hoá học và viết các PTHH xảy ra của Cvà h/c C (C + O2, C+CO2, CO2+ CaO...) -HS dựa vào bảng tuần hoàn để trả lời câu hỏi (ô nguyên tố, chu kì nhóm) -HS trả lời(trong 1 chu kì tính kim loại giảm dần, tính phi kim tăng dần ...) -HS trả lời (gồm 2 ý nghĩa như trang 99,100.) |
1.Tính chất hoá học của phi kim: tác dụng với KL tác dụng với H2 tác dụng với O 2.Tính chất hoá học của một số phi kim cụ thể: a.Tính chất hoá học của clo
b.Tính chất hoá học của các bon và hợp chất của cacbon: -C tác dụng với oxi -C tác dụng với CO2 -CO2 tác dụng với CaO -CO2 tác dụng với NaOH -CO2 tác dụng với C -CO tác dụng với O2 -CaCO3 bị nhiệt phân -Na2CO3 tác dụng với HCl 3. Bảng tuần hoàn các nguyên tố hoá học : a.Cấu tạo bảng tuần hoàn: -Ô nguyên tố, chu kì, nhóm. b.Sự biến đổi tính chất của các nguyên tố trong bảng tuần hoàn c.Ý nghĩa của bảng tuần hoàn (xem sgk trang 99,100) |
Hoạt động2:II/ Bài tập
| Giáo viên | Học sinh | Nội dung ghi bài |
|---|---|---|
-GV yêu cầu HS thảo luận nhóm để thực hiện BT số1 sgk trang 103 -GV yêu cầu đại diện nhóm trả lời -GV bổ sung và kết luận -GV yêu cầu các nhóm HS dựa vào sơ đô2 để hoàn thành BT2 (phương pháp như bài tập1) -BT4:GV yêu cầu HS tóm tắt đề bài và thảo luận để tìm ra kết quả -GV hướng dẫn HS từ số hiệu nguyên tử tìm số điện tích hạt nhân và số e . Từ chu kì 3→ số lớp, nhóm I → số e ngoài cùng → tính chất đặc trỨng -GV bổ sung và kết luận -GV yêu cầu HS tóm tắt đề bài . -GV hướng dẫn HS viết các PTHH, tìm khí X, các chất có trong dd A và các công thức cần sử dụng trong bài toán này -GV yêu cầu đại diện nhóm trình bày -GV bổ sung và kết luận |
-HS thảo luận nhóm dựa vào sơ đồ1 hoàn thành BT1 -Đại diện nhóm trả lời -Đại diện nhóm khác bổ sung -Các nhóm HS làm theo yêu cầu của GV -HS trả lời(nguyên tố A có Z= 11, chu kì 3, nhóm I .Tìm cấu tạo nguyên tử -HS thảo luận dưới sự hướng dẫn của GV -Đại diện nhóm trả lời -Nhóm khác bổ sung -HS trả lời: biết mMnO2=69,6g, Vdd = 500ml,CM = 4M -Tìm CM của dd A -HS giải BT dưới sự hướng dẫn của GV -Đại diện nhóm trình bày -nhóm khác bổ sung |
BT1 1. S + H2 → H2S 2 .S + Fe → FeS 3. S + O2 → SO2 BT2 1.Cl2 + H2 → 2HCl 2.Cl2 + Na → 2NaCl 3.Cl2 + NaOH → NaCl+NaClO+ H2O 4.Cl2 + H2O → HCl+ HclO BT4: Nguyên tố A có -Số hiệu nguyên tử 11 nên điện tích hạt nhân của nguyên tử A bằng 11, có 11 electron. -Nguyên tố A ở chu kì 3, nhóm I, nên nguyên tố A có 3 lớp electron, lớp ngoài cùng có 1 electron -Nguyên tố A ở đầu chu kì 3 nên A là kim loại hoạt động mạnh. -Tính kim loại của A(Na) yếu hơn nguyên tố đứng dưới số hiệu nguyên tử 19 là K và mạnh hơn nguyên tố đứng trên có số hiệu nguyên tử 3 là Li và mạnh hơn nguyên tố đứng bên có số hiệu nguyên tử 12 là Mg BT6:nMnO2 = 69,6: 87= 0,8 mol 500ml= 0,5l -Số mol của NaOH= 0,5 x 4= 2 mol -PTHH: MnO2+4 HCl → MnCl2+ Cl2+2H2O(1) 1mol 1mol 0,8mol 0,8mol Cl2+2NaOH→NaCl +NaClO+H2O(2) 1mol 2mol 1mol 1mol 0,8mol 1,6mol 0,8mol 0,8mol →NaOH dư 0,4mol →CM NaCl = 0,8 : 0,5= 1,6M →CMnaClO = 0,8 : 0,5 = 1,6M →CMnaOH = 0,4: 0,5 = 0,8M |
4) Tổng kết, dặn dò:
-GV khái quát lại nội dung chính của tiết luyện tập :tính chất của phi kim, ý nghĩa của bảng tuần hoàn, pp giải 1 bài toán dd
5) Dặn dò:về nhà làm các BT 3,4,5. ôn tập và chuẩn bị nội dung cho giờ thực hành , kẻ trước bảng tường trình