Cho phản ứng:2N2O5 (g) suy ra O2 (g) + 4NO2 (g). Sau thời gian từ giây 57 đến giây 116, nồng độ N2O5
Câu hỏi:
Cho phản ứng:
2N2O5 (g) ⟶ O2 (g) + 4NO2 (g)
Sau thời gian từ giây 57 đến giây 116, nồng độ N2O5 giảm từ 0,4 M về 0,35 M. Tốc độ trung bình của phản ứng trong khoảng thời gian trên là
A. 8,48.10−4 M / giây;
B. 4,42.10−4 M / giây;
C. 8,84.10−4 M / giây;
D. 4,24.10−4 M / giây.
Trả lời:
Đáp án đúng là: D
Tốc độ trung bình của phản ứng trong khoảng thời gian từ giây 57 đến giây 116 là:
 =
= 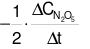 =
= 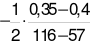 ≈ 4,24.10−4 (M / giây).
≈ 4,24.10−4 (M / giây).
Xem thêm bài tập trắc nghiệm Hóa 10 CTST có lời giải hay khác:
Câu 3:
Biểu thức tốc độ trung bình của phản ứng: aA + bB ⟶ cC + dD là
Xem lời giải »
Câu 4:
Cho phản ứng ở 45°C
2N2O5 (g) ⟶ O2 (g) + 2N2O4 (g)
Sau 275 giây đầu tiên, nồng độ của O2 là 0,188 M. Tính tốc độ trung bình của phản ứng theo O2 trong khoảng thời gian trên.
Xem lời giải »
Câu 5:
Cho phản ứng đơn giản có dạng: aA + bB ⟶ cC + dD
Mối quan hệ giữa nồng độ và tốc độ tức thời của phản ứng hóa học được biểu diễn bằng biểu thức
Xem lời giải »
Câu 6:
Cho phản ứng: 2SO2 (g) + O2 (g) 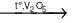 2SO3 (g)
2SO3 (g)
Biểu thức tốc độ thức thời của phản ứng theo định luật tác dụng khối lượng là
Xem lời giải »
Câu 8:
Hằng số tốc độ phản ứng k bằng vận tốc tức thời 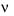 khi
khi
Xem lời giải »
 =
=  =
= 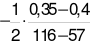 ≈ 4,24.10−4 (M / giây).
≈ 4,24.10−4 (M / giây).
 2SO3 (g)
2SO3 (g) khi
khi