Giải Hóa học 11 trang 16 Kết nối tri thức
Haylamdo biên soạn và sưu tầm với Giải Hóa học 11 trang 16 trong Bài 2: Cân bằng trong dung dịch nước Hóa học lớp 11 Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời các câu hỏi & làm bài tập Hóa học 11 trang 16.
Giải Hóa học 11 trang 16 Kết nối tri thức
Mở đầu trang 16 Hóa học 11:
Hình 2.1 cho thấy giá trị pH của dung dịch một số chất thông dụng. Vậy pH là gì? pH có ảnh hưởng gì đến đời sống? Xác định pH như thế nào?

Lời giải:
pH là một đại lượng liên hệ trực tiếp với nồng độ H+ để đánh giá tính acid, base của một dung dịch đã cho, với quy ước như sau:
pH = -log[H+] hoặc [H+] = 10-pH
Chỉ số pH có ý nghĩa to lớn trong thực tiễn, pH có liên quan đến sức khoẻ con người, sự phát triển của động, thực vật, …
Ví dụ:
+ Cá ưa sống trong môi trường nước có pH khoảng 7,5 – 8,5.
+ Một số loại thực vật chỉ phát triển tốt trong đất có giá trị pH thích hợp.
Hoạt động trang 16 Hóa học 11:
Tìm hiểu về sự điện li
Thí nghiệm thử tính dẫn điện của nước, muối ăn và dung dịch muối ăn được thực hiện như mô tả trong Hình 2.2.
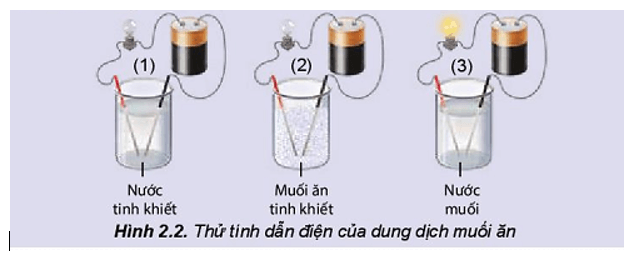
Thực hiện yêu cầu:
a) Hãy nhắc lại khái niệm dòng điện.
b) Đèn sáng cho thấy dung dịch NaCl dẫn điện, chứng tỏ dung dịch có hạt mang điện. Đó có thể là loại hạt nào (electron, phân tử NaCl, cation hay anion)?
c) Hãy giải thích sự tạo thành các hạt mang điện đó.
Lời giải:
a) Dòng điện là dòng dịch chuyển có hướng của các hạt mang điện.
b) Đèn sáng cho thấy dung dịch NaCl dẫn điện, chứng tỏ dung dịch có hạt mang điện. Đó có thể là cation và anion.
c) Giải thích:
NaCl là hợp chất ion, trong tinh thể có các ion Na+ và Cl- liên kết với nhau bằng lực hút tĩnh điện. Nước là một dung môi phân cực. Khi cho tinh thể NaCl vào nước, các ion Na+ và Cl- trên bề mặt hút các phân tử nước lại gần. Các phân tử nước hướng các đầu âm vào ion Na+, các đầu dương vào ion Cl- và làm yếu liên kết giữa các cation, anion trong tinh thể và khuếch tán vào nước.
Lời giải bài tập Hóa học lớp 11 Bài 2: Cân bằng trong dung dịch nước Kết nối tri thức hay khác:

