Giải Hóa học 11 trang 30 Kết nối tri thức
Haylamdo biên soạn và sưu tầm với Giải Hóa học 11 trang 30 trong Bài 4: Nitrogen Hóa học lớp 11 Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời các câu hỏi & làm bài tập Hóa học 11 trang 30.
Giải Hóa học 11 trang 30 Kết nối tri thức
Hoạt động 1 trang 30 Hóa học 11: : Sắp xếp các hợp chất sau vào vị trí tương ứng trong trục biểu diễn số oxi hoá của nitrogen: NO, N2O, NO2, NH3, HNO2, HNO3, NH4Cl, KNO2, NaNO3.
Lời giải:
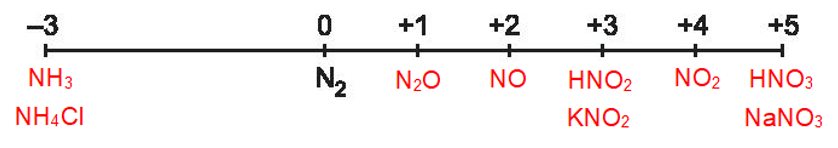
Hoạt động 2 trang 30 Hóa học 11: Dựa vào trục biểu diễn số oxi hoá của nitrogen để giải thích nitrogen có cả tính oxi hoá và tính khử. Viết một quá trình oxi hoá và một quá trình khử để minh hoạ.
Lời giải:
Khi tham gia phản ứng oxi hoá – khử, số oxi hoá của nitrogen có thể giảm hoặc tăng, do đó N2 thể hiện tính oxi hoá hoặc tính khử. Một số quá trình minh hoạ:
Quá trình oxi hoá: 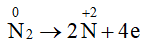
Quá trình khử: 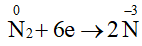
Hoạt động 1 trang 30 Hóa học 11: : Viết công thức electron, công thức Lewis và công thức cấu tạo của phân tử nitrogen.
Lời giải:
- Công thức electron của phân tử nitrogen:
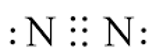
- Công thức Lewis của phân tử nitrogen:
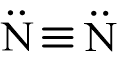
- Công thức cấu tạo của phân tử nitrogen:
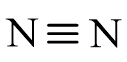
Hoạt động 2 trang 30 Hóa học 11: Từ cấu tạo phân tử, hãy cho biết tại sao phân tử N2 có năng lượng liên kết lớn. Dự đoán về khả năng hoạt động hoá học của nitrogen ở nhiệt độ thường.
Lời giải:
Phân tử nitrogen gồm hai nguyên tử, liên kết với nhau bằng liên kết ba (1 liên kết σ và 2 liên kết π) nên phân tử N2 có năng lượng liên kết lớn.
Dự đoán: Ở nhiệt độ và áp suất thường, nitrogen khó tham gia phản ứng hoá học.
Câu hỏi 1 trang 30 Hóa học 11: Dựa vào sự tương tác van der Waals, hãy giải thích tại sao đơn chất N2 khó hoá lỏng và ít tan trong nước.
Lời giải:
Tương tác vander Waals phụ thuộc vào hai yếu tố chính là số lượng eletron và điểm tiếp xúc giữa các phân tử suy ra giữa các phân tử nitrogen tồn tại tương tác van der Waals nhưng rất yếu. Do đó đơn chất N2 khó hoá lỏng và ít tan trong nước.
Lời giải Hóa 11 Bài 4: Nitrogen Kết nối tri thức hay khác:

