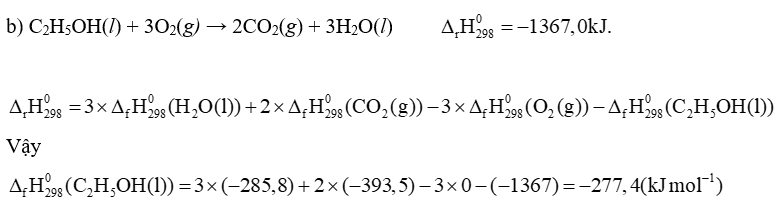Phản ứng của 1 mol enthanol lỏng với oxygen xảy ra theo phương trình
Giải SBT Hóa học 10 Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học
Haylamdo biên soạn và sưu tầm lời giải Bài 15.4 trang 45 sách bài tập Hóa học 10 trong Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học sách Cánh diều. Với lời giải chi tiết hy vọng sẽ giúp các học sinh dễ dàng nắm được cách làm bài tập trong SBT Hóa học 10.
Bài 15.4 trang 45 sách bài tập Hóa học 10: Phản ứng của 1 mol enthanol lỏng với oxygen xảy ra theo phương trình:
C2H5OH(l) + O2(g) → CO2(g) + H2O(l)(1)
a) Những nhận định nào sau đây là đúng?
(1) Đây là phản ứng tỏa nhiệt vì nó tạo ra khí CO2 và nước lỏng.
(2) Đây là phải là phản ứng oxi hóa – khử với tổng số hệ số cân bằng trong phương trình phản ứng là 9.
(3) Biến thiên enthalpy chuẩn của phản ứng sẽ thay đổi nếu nước tạo ra ở thể khí.
(4) Sản phẩm của phản ứng chiếm một thể tích lớn hơn so với chất phản ứng.
A. (1), (2).
B. (1), (2), (3).
C. (1), (3), (4).
D. (3), (4).
E. (1).
G. (2), (3).
b) Biến thiên enthalpy chuẩn kèm theo quá trình khi 1 mol ethanol lỏng cháy hoàn toàn trong oxygen là , xác định enthalpy hình thành chuẩn của C2H5OH (lỏng).
(Những số liệu cần thiết được cho trong Phụ lục 3, SGK Hóa học 10, Cánh Diều).
Lời giải:
a) Đáp án đúng là: G
C2H5OH(l) + 3O2(g) → 2CO2(g) + 3H2O(l)(1)
Phát biểu (1) sai vì để xét phản ứng tỏa nhiệt hay thu nhiệt cần dựa vào năng lượng hóa học của phản ứng.
Phát biểu (2) đúng, tổng hệ số cân bằng của phản ứng là 1 + 3 + 2 + 3 = 9.
Phát biểu (3) đúng.
Phát biểu (4) sai, sản phẩm của phản ứng chiếm một số mol lớn hơn so với chất phản ứng.