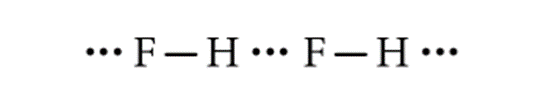Giải SBT Hóa học 10 trang 36 Cánh diều
Haylamdo biên soạn và sưu tầm lời giải SBT Hóa học 10 trang 36 trong Bài 12: Liên kết hydrogen và tương tác Van Der Waals sách Cánh diều. Với lời giải chi tiết hy vọng sẽ giúp các học sinh dễ dàng nắm được cách làm bài tập SBT Hóa học 10.
Giải SBT Hóa học 10 trang 36 Cánh diều
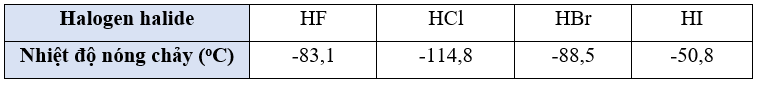
Bài 12.13 trang 36 sách bài tập Hóa học 10: Hãy giải thích sự biến đổi về nhiệt độ nóng chảy của dãy hydrogen halide sau:
Lời giải:
- Từ HCl đến HI do kích thước nguyên tử halogen tăng, tương tác van der Waals giữa các phân tử tăng nên nhiệt độ nóng chảy tăng.
- Giữa các phân tử HF có liên kết hydrogen nên nhiệt độ nóng chảy cao hơn so với HCl.
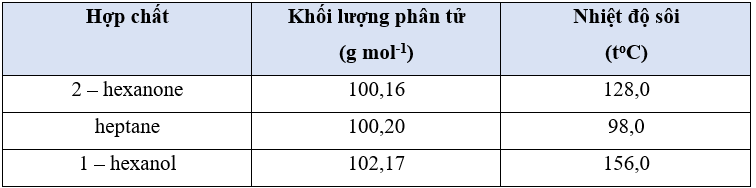
Bài 12.14 trang 36 sách bài tập Hóa học 10: Nhiệt độ sôi của ba hợp chất được cho trong bảng sau:
Không cần tra cứu cấu trúc, em hãy trả lời các câu hỏi sau về ba hợp chất này:
a) Hợp chất nào có thể hình thành liên kết hydrogen?
b) Hợp chất nào phân cực nhưng không hình thành liên kết hydrogen?
c) Hợp chất nào ít phân cực, không hình thành liên kết hydrogen?
Lời giải:
a) Ba chất có khối lượng phân tử tương đương nhau nên chất có nhiệt độ sôi cao nhất là chất có thể hình thành liên kết hydrogen, đó là 1 – hexanol.
b) Chất có phân tử phân cực sẽ có tương tác van der Waals giữa các phân tử mạnh hơn, có nhiệt độ sôi xếp thứ hai (ảnh hưởng của liên kết hydrogen tới nhiệt độ sôi là mạnh hơn tương tác van der Waals), do đó chất phân cực là 2 – hexanone.
c) Vậy hợp chất ít phân cực, không hình thành liên kết hydrogen là hợp chất còn lại heptane.
Lời giải sách bài tập Hóa học lớp 10 Bài 12: Liên kết hydrogen và tương tác Van Der Waals Cánh diều hay khác: