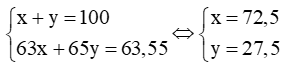Giải SBT Hóa học 10 trang 9 Cánh diều
Haylamdo biên soạn và sưu tầm lời giải SBT Hóa học 10 trang 9 trong Bài 3: Nguyên tố hóa học sách Cánh diều. Với lời giải chi tiết hy vọng sẽ giúp các học sinh dễ dàng nắm được cách làm bài tập SBT Hóa học 10.
Giải SBT Hóa học 10 trang 9 Cánh diều
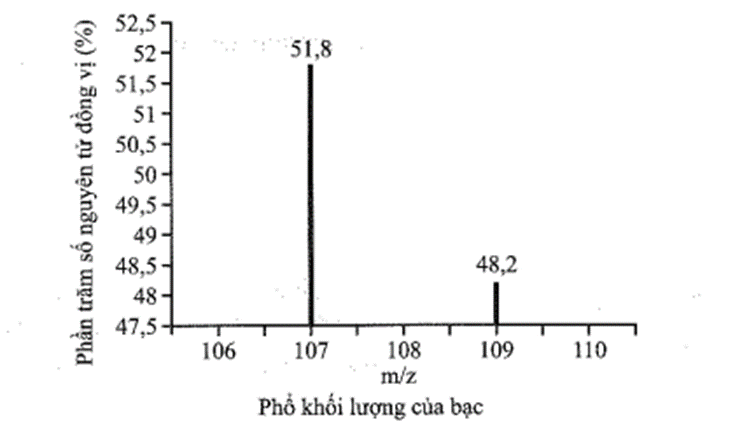
Bài 3.10 trang 9 sách bài tập Hóa học 10: Bạc có hai đồng vị bền trong tự nhiên: 107Ag có hàm lượng tương đối là 51,8%; 109Ag có hàm lượng tương đối là 48,2%. Hãy vẽ phổ khối lượng của bạc và tính nguyên tử khối trung bình của Ag.
Lời giải:
Nguyên tử khối trung bình của Ag là:
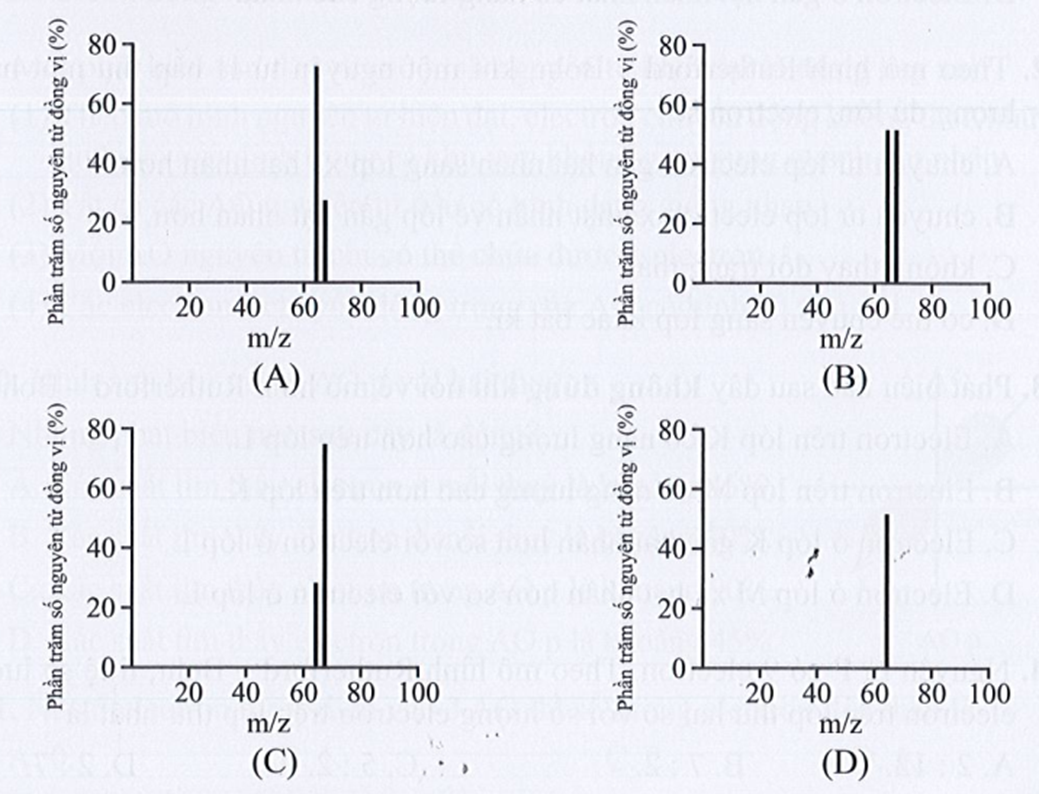
Bài 3.11 trang 9 sách bài tập Hóa học 10: Đồng có hai đồng vị bền trong tự nhiên là 63Cu và 65Cu. Nguyên tử khối trung bình của đồng là 63,55 (điện tích z của các ion đồng vị đồng đều bằng 1+). Hình vẽ phổ khối nào dưới đây là đúng?
Lời giải:
Đáp án đúng là: A
Gọi % số nguyên tử của mỗi đồng vị 63Cu và 65Cu lần lượt là x và y (%).
Theo bài ra, ta có hệ phương trình:
Hình vẽ phổ khối đúng là: A
Lời giải sách bài tập Hóa học lớp 10 Bài 3: Nguyên tố hóa học Cánh diều hay khác: