SBT Hóa 10 trang 16 Chân trời sáng tạo
Haylamdo biên soạn và sưu tầm lời giải SBT Hóa 10 trang 16 sách Chân trời sáng tạo hay, đầy đủ nhất. Hy vọng rằng với lời giải chi tiết sẽ giúp học sinh dễ dàng nắm được cách làm bài và làm tốt bài tập trong Sách bài tập Hóa 10 Bài 4.
Giải SBT Hóa học 10 trang 16 Chân trời sáng tạo
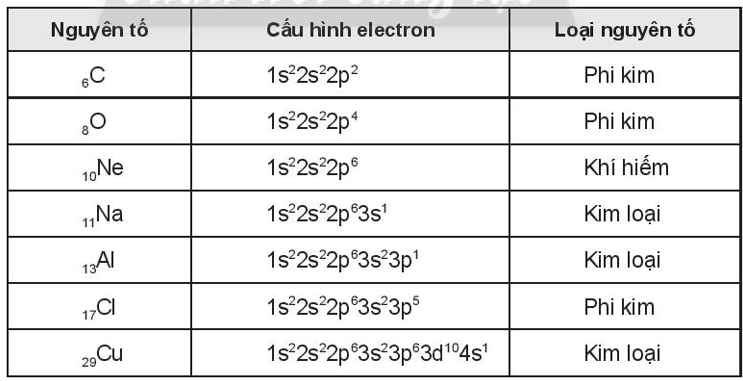
Bài 4.12 trang 16 SBT Hóa học 10: Viết cấu hình electron của nguyên tử các nguyên tố: . Hãy cho biết các nguyên tố này là kim loại, phi kim hay khí hiếm.
Lời giải:
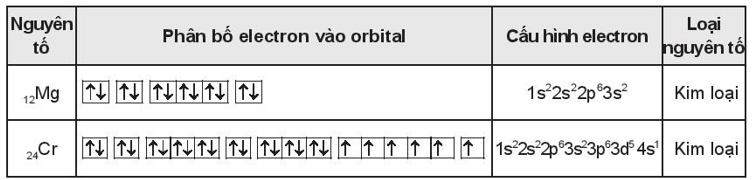
Bài 4.13 trang 16 SBT Hóa học 10: Viết cấu hình electron dưới dạng ô lượng tử của các nguyên tử 12Mg và 24Cr. Hãy cho biết các nguyên tố này là kim loại, phi kim hay khí hiếm.
Lời giải:
Bài 4.14 trang 16 SBT Hóa học 10: Nguyên tố X được sử dụng rộng rãi để chống đóng băng và khử băng như một chất bảo quản. Nguyên tố Y là nguyên tố thiết yếu cho các cơ thể sống, đồng thời nó được sử dụng nhiều trong công việc sản xuất phân bón. Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử của nguyên tố Y có một electron ở lớp ngoài cùng 4s. Nguyên tử X và Y có số electron hơn kém nhau là 3. Nguyên tử X, Y lần lượt là
A. khí hiếm và kim loại
B. kim loại và khí hiếm
C. kim loại và kim loại
D. phi kim và kim loại
Lời giải:
Đáp án đúng là: D
- Nguyên tử của nguyên tố Y có một electron ở lớp ngoài cùng 4s nên cấu hình electron nguyên tử Y là: 1s22s22p63s23p64s1.
Y là kim loại do có 1 electron ở lớp ngoài cùng.
- Nguyên tử X và Y có số electron hơn kém nhau là 3 nên số electron của X là:
19 – 3 = 16.
Cấu hình electron của X: 1s22s22p63s23p4. X là phi kim do có 6 electron ở lớp ngoài cùng.
Bài 4.15 trang 16 SBT Hóa học 10: X được dùng làm chất bán dẫn trong kĩ thuật vô tuyến điện, chế tạo pin mặt trời. Nguyên tử của nguyên tố X có 3 lớp electron. Lớp ngoài cùng có 4 electron. Xác định số hiệu nguyên tử của X và tên nguyên tố X. Viết cấu hình electron của X.
Lời giải:
X có 3 lớp electron, lớp 1 có 2 electron, lớp 2 có 8 electron, lớp 3 có 4 electron.
Số hiệu nguyên tử X là 2 + 8 + 4 = 14. Vậy X là Si (Silicon).
Cấu hình electron của X là: 1s22s22p63s23p2 hay [Ne] 3s23p2.
Bài 4.16 trang 16 SBT Hóa học 10: X được dùng để làm vỏ phủ vệ tinh nhân tạo hay khí cầu nhằm tăng nhiệt độ nhờ có tính hấp thụ bức xạ điện từ mặt trời khá tốt. Y là một trong những thành phần để điều chế nước Javen tẩy trắng quần áo, vải sợi. Nguyên tử của nguyên tố X có tổng số hạt electron trong các phân lớp p là 7. Số hạt mang điện của một nguyên tử Y nhiều hơn số hạt mang điện của một nguyên tử X là 8 hạt. Tìm các nguyên tố X và Y.
Lời giải:
- Nguyên tử nguyên tố X có tổng các electron trong các phân lớp p là 7, nên cấu hình electron nguyên tử X là: 1s22s22p63s23p1 ⇒ ZX = 13, X là Al (Aluminium).
- Số hạt mang điện của một nguyên tử Y nhiều hơn số hạt mang điện của một nguyên tử X là 8 hạt nên: 2ZY – 2ZX = 8 ⇒ ZY = ZX + 4 = 17, Y là Cl (Chlorine).
Bài 4.17 trang 16 SBT Hóa học 10: Một nguyên tố mà nguyên tử có 4 lớp electron, có phân lớp d, lớp ngoài cùng đã bão hòa electron. Hãy tính tổng số electron s và electron p của nguyên tố này.
Lời giải:
Nguyên tố có phân lớp d, có 4 lớp electron nên electron cuối cùng trên phân lớp 3d.
Cấu hình electron của nguyên tố này có dạng: 1s22s22p63s23p63dx4s2.
Vậy tổng số electron s và electron p của nguyên tố là: 2 + 2 + 6 + 2 + 6 + 2 = 20.
Bài 4.18 trang 16 SBT Hóa học 10: A được dùng để chế tạo đèn có cường độ sáng cao. Nguyên tử A có electron ở phân lớp 3d chỉ bằng một nửa phân lớp 4s. Viết cấu hình electron của nguyên tử A và tên nguyên tố A.
Lời giải:
Nguyên tử A có electron ở phân lớp 3d nên phân lớp 4s của A đã bão hòa (với 2 electron). Vậy số electron trên phân lớp 3d của A là 1.
Cấu hình electron nguyên tử A: 1s22s22p63s23p63d14s2.
Bài 4.19 trang 16 SBT Hóa học 10: Nguyên tố A có cấu hình electron lớp ngoài cùng là 4s1. Nguyên tố B có phân lớp cuối là 3p5. Viết cấu hình electron đầy đủ của A, B. Xác định tên A, B.
Lời giải:
- Nguyên tố B có phân lớp cuối là 3p5 nên có cấu hình electron: 1s22s22p63s23p5.
⇒ ZB = 17, B là chlorine (Cl).
- Nguyên tố A có cấu hình electron lớp ngoài cùng là 4s1 nên có 3 trường hợp có thể xảy ra:
+ Trường hợp 1: Nguyên tử A không có electron ở 3d. Cấu hình electron của A là: 1s22s22p63s23p64s1 ⇒ ZA = 19, A là potassium (K).
+ Trường hợp 2: Nguyên tử A có phân lớp 3d nửa bão hòa. Cấu hình electron của A là: 1s22s22p63s23p63d54s1 ⇒ ZA = 24, A là chromium (Cr).
+ Trường hợp 3: Nguyên tử A có phân lớp 3d bão hòa. Cấu hình electron của A là: 1s22s22p63s23p63d104s1 ⇒ ZA = 29, A là copper (Cu).
Lời giải Sách bài tập Hóa học lớp 10 Bài 4: Cấu trúc lớp vỏ electron của nguyên tử Chân trời sáng tạo hay khác: