Giải SBT Hóa 10 trang 20 Chân trời sáng tạo
Haylamdo biên soạn và sưu tầm lời giải Giải SBT Hóa 10 trang 20 sách Chân trời sáng tạo. Với lời giải chi tiết nhất hy vọng sẽ giúp học sinh dễ dàng nắm được cách làm bài tập Sách bài tập Hóa học 10.
Giải SBT Hóa học 10 trang 20 Chân trời sáng tạo
Bài 5.5 trang 20 SBT Hóa học 10: Sulfur dạng kem bôi được sử dụng để điều trị mụn trứng cá. Nguyên tử sulfur có phân lớp electron ngoài cùng là 3p4. Phát biểu nào sau đây là sai khi nói về nguyên tử sulfur?
A. Lớp ngoài cùng của sulfur có 6 electron.
B. Hạt nhân nguyên tử sulfur có 16 electron.
C. Trong bảng tuần hoàn sulfur nằm ở chu kì 3.
D. Sulfur nằm ở nhóm VIA.
Lời giải:
Đáp án đúng là: B
Trong hạt nhân nguyên tử không có chứa electron.
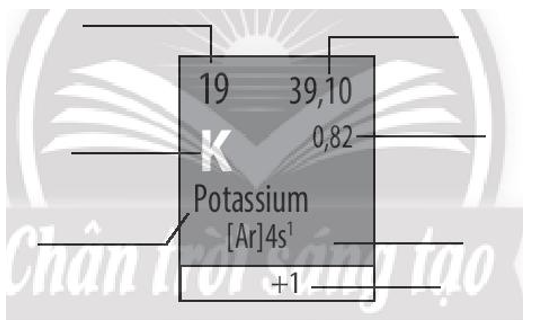
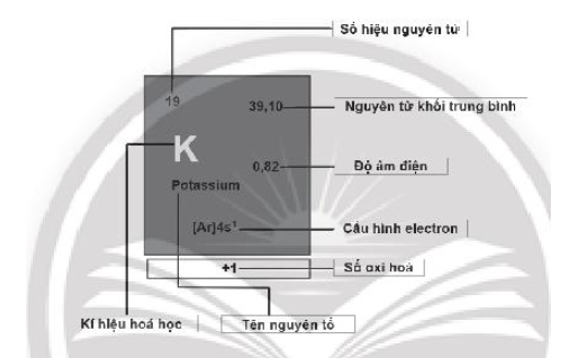
Bài 5.6 trang 20 SBT Hóa học 10: Hãy cho biết ý nghĩa của các thông tin có trong ô nguyên tố sau:
Lời giải:
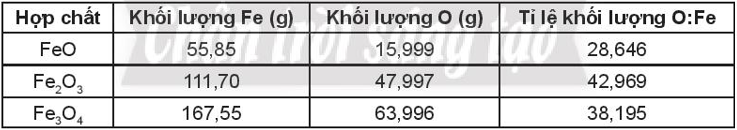
Bài 5.7 trang 20 SBT Hóa học 10: Sử dụng bảng tuần hoàn các nguyên tố hóa học trong SGK (Hình 5.2 trang 37), hoàn thành những thông tin còn thiếu trong bảng sau.
Lời giải:
Bài 5.8 trang 20 SBT Hóa học 10: Hãy giải thích vì sao chu kì 3 chỉ có 8 nguyên tố.
Lời giải:
Các nguyên tố ở chu kì 3 có 3 lớp electron. Lớp thứ 3 có 3 phân lớp là 3s, 3p và 3d. Do trật tự phân mức năng lượng là: 1s 2s 2p 3s 3p 4s 3d … nên chu kì 3 chỉ có 8 nguyên tố ứng với số electron trên lớp thứ 3 thay đổi từ 1 đến 8 hay cấu hình electron thay đổi từ 3s13p0 đến 3s23p6.
Bài 5.9 trang 21 SBT Hóa học 10: Xác định vị trí của nguyên tố (ô, chu kì và nhóm) của nguyên tố có:
a. Số hiệu nguyên tử là 20, là nguyên tố giúp xương chắc khỏe, phòng ngừa những bệnh loãng xương, giảm tình trạng đau nhức và khó khăn trong vận động, làm nhanh lành các vết nứt gãy trên xương.
b. 9 electron, được sử dụng để điều chế một số dẫn xuất hydrocarbon, làm sản phẩm trung gian để sản xuất ra chất dẻo.
c. 28 proton, được dùng trong việc chế tạo hợp kim chống ăn mòn.
d. Số khối là 52 và 28 neutron, dùng chế tạo thép không gỉ.
Lời giải:
a) Z = 20, cấu hình electron: 1s22s22p63s23p64s2
Nguyên tố này thuộc ô 20 (Z = 20); chu kì 4 (do có 4 lớp electron); nhóm IIA (do nguyên tố s, 2 electron lớp ngoài cùng).
b) Nguyên tử có 9 electron nên Z = 9, cấu hình electron: 1s22s22p5
Nguyên tố này thuộc ô 9 (Z = 9); chu kì 2 (do có 2 lớp electron); nhóm VIIA (do nguyên tố p, 7 electron lớp ngoài cùng).
c) Nguyên tử có 28 proton nên Z = 28, cấu hình electron: 1s22s22p63s23p63d84s2.
Nguyên tố này thuộc ô 28 (Z = 28), chu kì 4 (do có 4 lớp electron), nhóm VIIIB (do nguyên tố d, có tổng số electron trên 2 phân lớp 3d và 4s là 10).
d) Z = A – N = 52 – 28 = 24, cấu hình electron: 1s22s22p63s23p63d54s1
Nguyên tố này thuộc ô 24 (Z = 24), chu kì 4 (do có 4 lớp electron), nhóm VIB (do có 6 electron hóa trị).
Lời giải Sách bài tập Hóa học lớp 10 Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học Chân trời sáng tạo hay khác: