Giải SBT Hóa 10 trang 40 Chân trời sáng tạo
Haylamdo biên soạn và sưu tầm lời giải Giải SBT Hóa 10 trang 40 sách Chân trời sáng tạo. Với lời giải chi tiết nhất hy vọng sẽ giúp học sinh dễ dàng nắm được cách làm bài tập Sách bài tập Hóa học 10.
Giải SBT Hóa học 10 trang 40 Chân trời sáng tạo
Bài 11.5 trang 40 SBT Hóa học 10: Điều nào sau đây đúng khi nói về liên kết hydrogen nội phân tử?
A. Là lực hút giữa các proton của nguyên tử này với các electron ở nguyên tử khác.
B. Là lực hút tĩnh điện giữa nguyên tử H (thường trong các liên kết H – F, H – N, H – O) ở một phân tử với một trong các nguyên tử có độ âm điện mạnh (thường là N, O, F) ở ngay chính phân tử đó.
C. Là lực hút giữa các ion trái dấu
D. Là lực hút giữa các phân tử có chứa nguyên tử hydrogen.
Lời giải:
Đáp án đúng là: B
Liên kết hydrogen nội phân tử là lực hút tĩnh điện giữa nguyên tử H (thường trong các liên kết H – F, H – N, H – O) ở một phân tử với một trong các nguyên tử có độ âm điện mạnh (thường là N, O, F) ở ngay chính phân tử đó.
Bài 11.6 trang 40 SBT Hóa học 10: Tương tác van der Waals xuất hiện là do sự hình thành các lưỡng cực tạm thời cũng như các lưỡng cực cảm ứng. Các lưỡng cực tạm thời xuất hiện là do sự chuyển động của
A. các nguyên tử trong phân tử
B. các electron trong phân tử
C. các proton trong hạt nhân
D. các neutron và proton trong hạt nhân
Lời giải:
Đáp án đúng là: B
Tương tác van der Waals xuất hiện là do sự hình thành các lưỡng cực tạm thời cũng như các lưỡng cực cảm ứng. Các lưỡng cực tam thời xuất hiện là do sự chuyển động của các electron trong phân tử, đó là lúc electron tập trung về một phía trong phân tử.
Bài 11.7 trang 40 SBT Hóa học 10: Trong các khí hiếm sau, khí hiếm có nhiệt độ sôi cao nhất là
A. Ne
B. Xe
C. Ar
D. Kr
Lời giải:
Đáp án đúng là: B
Trong 4 nguyên tử Ne, Xe, Ar, Kr thì Xe có khối lượng phân tử lớn nhất nên tương tác van der Waals giữa các phân tử Xe là lớn nhất, dẫn đến khí hiếm Xe có nhiệt độ sôi cao nhất.
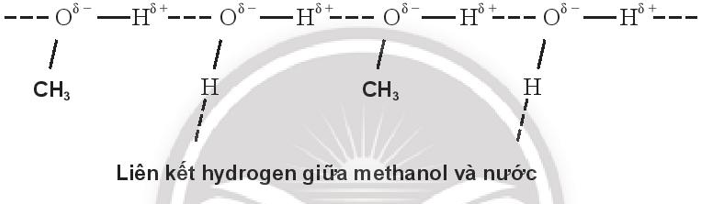
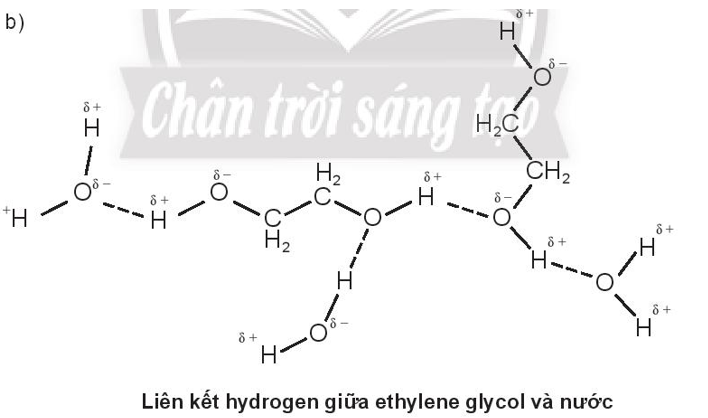
Bài 11.8 trang 40 SBT Hóa học 10: Biểu diễn liên kết hydrogen giữa các phân tử sau:
a. methanol (CH3OH) và nước.
b. ethylene glycol (HOCH2CH2OH) và nước
Từ đó nhận xét tính tan của methanol và ethylene glycol trong nước.
Lời giải:
a)
Do methanol và ethylene glycol tạo được liên kết hydrogen với nước nên methanol và ethylene glycol đều tan vô hạn trong nước.
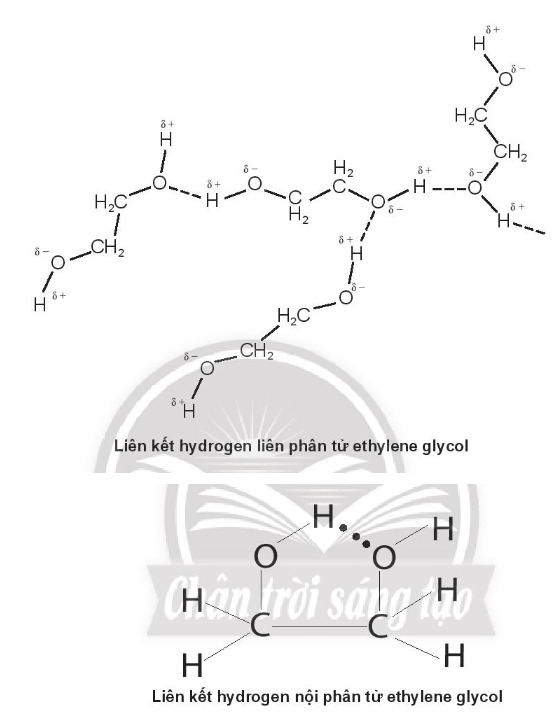
Bài 11.9 trang 40 SBT Hóa học 10: Ethylene glycol (HOCH2CH2OH) là một chất chống đông trong công nghiệp ô tô, hàng không do có khả năng can thiệp vào liên kết hydrogen của nước, làm các phân tử nước khó liên kết hơn, khiến nước khó đóng băng hơn. Biểu diễn liên kết hydrogen liên phân tử và nội phân tử trong ethylene glycol.
Lời giải:
Bài 11.10 trang 40 SBT Hóa học 10: Hãy so sánh tương tác van der Waals với liên kết ion.
Lời giải:
Tương tác van der Waals và liên kết ion đều là các lực hút tĩnh điện. Tuy nhiên, tương tác van der Waals là lực hút tĩnh điện giữa các phân tử trung hòa nên yếu hơn nhiều so với liên kết ion là lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Bài 11.11 trang 40 SBT Hóa học 10: Thiết bị chụp cộng hưởng từ hạt nhân (NMR) sử dụng nitrogen lỏng để làm mát nam châm siêu dẫn. Nitrogen lỏng sôi ở - 195,8oC. Dự đoán nhiệt độ sôi của oxygen lỏng sẽ cao hay thấp hơn so với nitrogen lỏng? Giải thích.
Lời giải:
Oxygen có khối lượng phân tử cao hơn nitrogen, do đó tương tác van der Waals giữa các phân tử oxygen mạnh hơn so với nitrogen. Kết quả là oxygen lỏng có nhiệt độ sôi cao hơn nitrogen lỏng.
Thực nghiệm đã chứng minh, oxygen lỏng sôi ở -183oC, còn nitrogen lỏng sôi ở -195,8oC.
Lời giải Sách bài tập Hóa học lớp 10 Bài 11: Liên kết hydrogen và tương tác van der waals Chân trời sáng tạo hay khác: