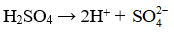10 mL dung dịch sulfuric acid 5.10-3 M được cho vào một bình định mức dung tích 100 mL
Sách bài tập Hóa học 11 Bài 3: pH của dung dịch. Chuẩn độ acid – base
Bài 3.15 trang 13 Sách bài tập Hóa học 11:
a) 10 mL dung dịch sulfuric acid 5.10-3 M được cho vào một bình định mức dung tích 100 mL.
a1) Tính pH của dung dịch sulfuric acid (cho rằng H2SO4 là acid mạnh phân li trong nước hoàn toàn cả hai proton H+).
a2) Thêm nước vào đến vạch của bình định mức thu được 100 mL dung dịch. Xác định pH của dung dịch đã pha loãng.
b) Viết phưong trình hoá học của phản ứng giữa sulfuric acid với dung dịch sodium hydroxide.
c) Dung dịch pha loãng ở phần a2 được dùng để chuẩn độ 25,0 mL dung dịch sodium hydroxide 1,00.10-4 M.
c1) Dự đoán hiện tượng quan sát được khi chuẩn độ đạt đến điểm tương đương nếu dùng phenolphthalein làm chất chỉ thị cho phép chuẩn độ trên.
c2) Xác định thể tích acid cần dùng khi phép chuẩn độ kết thúc.
Lời giải:
a)
a1) [H+] = 2.5.10-3 = 10-2 (M); pH = –lg(10-2) = 2.
a2) pH = 3 vì dung dịch được pha loãng 10 lần.
b) Phương trình hoá học của phản ứng xảy ra:
H2SO4 + 2NaOH ⟶ Na2SO4 + 2H2O
c)
c1) Nhỏ 1 giọt phenolphthalein vào dung dịch NaOH, dung dịch có màu hồng. Chuẩn độ bằng dung dịch H2SO4, màu hồng sẽ nhạt dần, khi đạt tới điểm tương đương sẽ mất màu.
c2) Thể tích dung dịch acid cần dùng là:
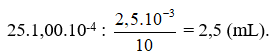
Lời giải SBT Hóa 11 Bài 3: pH của dung dịch. Chuẩn độ acid – base hay khác: