Cho các biện pháp: (1) tăng nhiệt độ (2) tăng áp suất chung của hệ phản ứng
Sách bài tập Hóa học 11 Bài 1: Khái niệm về cân bằng hóa học - Chân trời sáng tạo
Trong quy trình sản xuất sulfuric acid (H2SO4) có giai đoạn dùng dung dịch H2SO4 98% hấp thụ sulfur trioxide (SO3) thu được oleum (H2SO4.nSO3). Sulfur trioxide được tạo thành bằng cách oxi hoá sulfur dioxide bằng oxygen hoặc lượng dư không khí ở nhiệt độ 450 °C - 500 °C, chất xúc tác vanadium(V) oxide (V2O5) theo phương trình hoá học:
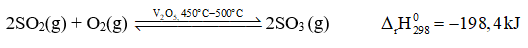
Bài 1.11 trang 6 Sách bài tập Hóa học 11: Cho các biện pháp: (1) tăng nhiệt độ, (2) tăng áp suất chung của hệ phản ứng, (3) hạ nhiệt độ, (4) dùng thêm chất xúc tác V2O5, (5) giảm nồng độ SO3, (6) giảm áp suất chung của hệ phản ứng. Những biện pháp nào làm cân bằng trên chuyển dịch theo chiều thuận?
A. (1), (2), (4), (5). B. (2), (3), (5).
C. (2), (3), (4), (6). D. (1), (2), (4).
Lời giải:
Đáp án đúng là: B
(2) Tăng áp suất chung Cân bằng chuyển dịch theo chiều làm giảm áp suất (tức giảm số mol khí) Cân bằng chuyển dịch theo chiều thuận.
(3) Phản ứng trên là phản ứng tỏa nhiệt 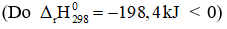
(5) Khi giảm nồng độ SO3 Cân bằng chuyển dịch theo chiều tăng nồng độ SO3; tức là chiều thuận.
Lời giải SBT Hóa 11 Bài 1: Khái niệm về cân bằng hóa học hay khác:
Bài 1.3 trang 5 Sách bài tập Hóa học 11: Cân bằng hoá học sẽ chuyển dịch theo chiều nào khi ....
Bài 1.6 trang 6 Sách bài tập Hóa học 11: Cân bằng hoá học sẽ chuyển dịch theo chiều nào khi ....
Bài 1.8 trang 6 Sách bài tập Hóa học 11: Nồng độ ban đầu của SO2 và O2 tương ứng là 4 M và 2 M ....
Bài 1.15 trang 7 Sách bài tập Hóa học 11: Cho vào bình kín (dung tích 1 L) 1 mol H2 và 1 mol I2 ....

