Aspirin là một loại thuốc có thành phần chính là acetylsalicylic acid
pH HOH
Sách bài tập Hóa học 11 Bài 2: Cân bằng trong dung dịch nước - Kết nối tri thức
Bài 2.10 trang 11 Sách bài tập Hóa học 11: Aspirin là một loại thuốc có thành phần chính là acetylsalicylic acid. Nếu hoà tan thuốc này vào nước, người ta xác định được pH của dung dịch tạo thành là 2,8 . Tính nồng độ H+ và nồng OH- của dung dịch tạo thành.
Lời giải:
pH= -log [H+] => [H+] = 10-pH.
Nồng độ của ion H+ = 10-2,8; nồng độ của ion OH- là [OH-] = 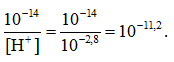
Lời giải SBT Hóa 11 Bài 2: Cân bằng trong dung dịch nước hay khác:
Bài 2.1 trang 9 Sách bài tập Hóa học 11: Thêm nước vào 10 mL dung dịch NaOH 1,0 mol/L, thu được 1000 mL dung dịch A ....
Bài 2.2 trang 10 Sách bài tập Hóa học 11: Trong dung dịch trung hoà về điện, tổng đại số điện tích của các ion bằng không ....
Bài 2.3 trang 10 Sách bài tập Hóa học 11: Trong dung dịch nước, cation kim loại mạnh, gốc acid mạnh không bị thuỷ phân ....
Bài 2.4 trang 10 Sách bài tập Hóa học 11: Trong các dung dịch acid sau có cùng nồng độ 0,1 M, dung dịch nào có pH cao nhất? ....
Bài 2.5 trang 10 Sách bài tập Hóa học 11: Tại khu vực bị ô nhiễm, pH của nước mưa đo được là 4,5 ....
Bài 2.6 trang 10 Sách bài tập Hóa học 11: Viết phương trình điện li của các chất sau: Acid yếu: HCOOH, HCN; acid mạnh: HCl, HNO3 ....