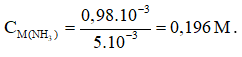Một học sinh thực hiện thí nghiệm sau: Lấy 10 mL dung dịch HCl 0,2 M
10 mLHCl 0,2 M5 mLNH AHClANaOH 0,110,2 mLNH
Sách bài tập Hóa học 11 Bài 2: Cân bằng trong dung dịch nước - Kết nối tri thức
Bài 2.14 trang 12 Sách bài tập Hóa học 11: Một học sinh thực hiện thí nghiệm sau: Lấy 10 mL dung dịch HCl 0,2 M cho vào 5 mL dung dịch NH3 thu được dung dịch A. Chuẩn độ lượng HCl dư trong dung dịch A bằng dung dịch NaOH 0,1 thấy phản ứng hết10,2 mL. Tính nồng độ của dung dịch NH3 ban đầu.
Lời giải:
Phương trình hóa học:
NH3 + HCl → NH4Cl
HCldư + NaOH → NaCl + H2O
Số mol HCl ban đầu là: nHCl = 10.10-3.0,2 = 2.10-3 (mol)
Số mol HCl dư = số mol NaOH phản ứng = 10,2.10-3.0,1=1,02.10-3 (mol)
Số mol HCl phản ứng với NH3 là:
nHCl = nHCl ban đầu - nHCl dư = 2.10-3 – 1,02.10-3 = 0,98.10-3(mol)
Vậy số mol NH3 = 0,98.10-3 (mol)
=> Nồng độ của dung dịch NH3 đã dùng là:
Lời giải SBT Hóa 11 Bài 2: Cân bằng trong dung dịch nước hay khác: