SBT Khoa học tự nhiên 7 trang 11 Cánh diều
Haylamdo biên soạn và sưu tầm lời giải SBT KHTN 7 trang 11 trong Bài 3: Sơ lược về bảng tuần hoàn các nguyên tố hóa học. Với lời giải ngắn gọn nhưng đủ ý hy vọng sẽ giúp học sinh dễ dàng nắm được cách làm bài tập Sách bài tập KHTN 7.
Giải SBT Khoa học tự nhiên 7 trang 11 Cánh diều
Bài 3.6 trang 11 sách bài tập KHTN 7: Cho biết một nguyên tử của nguyên tố X có điện tích hạt nhân là +17. Hãy chọn câu đúng trong các câu sau:
A. Nguyên tố X ở chu kì 3, nhóm VIIA; là phi kim; có 17 proton, 7 electron.
B. Nguyên tố X ở chu kì 3, nhóm VIIA; là phi kim; có 17 proton, 17 electron.
C. Nguyên tố X ở chu kì 2, nhóm VIIA; là kim loại; có 17 proton, 17 electron.
D. Nguyên tố X ở chu kì 2, nhóm VIIA; là phi kim; có 17 proton, 7 electron.
Lời giải:
Đáp án đúng là: B
- X có điện tích hạt nhân là +17 nên nguyên tử X có 17 proton và 17 electron (loại đáp án A và D).
- X có 17 electron được phân vào 3 lớp, vậy X thuộc chu kì 3 (loại đáp án C).
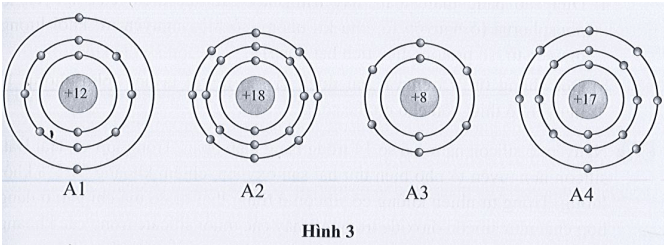
Bài 3.7 trang 11 sách bài tập KHTN 7: Quan sát mô hình cấu tạo của bốn nguyên tử thuộc bốn nguyên tố có kí hiệu lần lượt là A1, A2, A3, A4 dưới đây:
Điền các thông tin còn thiếu vào bảng sau đây:
Nguyên tử nguyên tố |
A1 |
A2 |
A3 |
A4 |
Số lớp electron |
||||
Số electron lớp ngoài cùng |
||||
Số hiệu nguyên tử |
||||
Số proton |
Lời giải:
Chú ý: Trong nguyên tử:
Số hiệu nguyên tử = số proton = số electron.
Nguyên tử nguyên tố |
A1 |
A2 |
A3 |
A4 |
Số lớp electron |
3 |
3 |
2 |
3 |
Số electron lớp ngoài cùng |
2 |
8 |
6 |
7 |
Số hiệu nguyên tử |
12 |
18 |
8 |
17 |
Số proton |
12 |
18 |
8 |
17 |
Bài 3.8 trang 11 sách bài tập KHTN 7: Quan sát bảng tuần hoàn các nguyên tố hóa học và cho biết:
a) Một số thông tin (ô nguyên tố, chu kì, nhóm; là nguyên tố kim loại, phi kim hay khí hiếm) của những nguyên tố có số thứ tự lần lượt là 6, 9 và 19.
b) Vì sao các nguyên tố Li, Na và K được xếp vào cùng một cột/ nhóm? Giải thích tương tự với các nguyên tố O, S và Se.
c) Vì sao các nguyên tố B, C, N, O và F được xếp vào cùng một hàng/ chu kì? Giải thích tương tự với các nguyên tố Na, Mg và Al.
d) Vì sao các nguyên tố He, Ne và Ar được xếp vào cùng một cột/ nhóm?
Lời giải:
a) Một số thông tin (ô nguyên tố, chu kì, nhóm; là nguyên tố kim loại, phi kim hay khí hiếm) của những nguyên tố có số thứ tự lần lượt là 6, 9 và 19 được thể hiện trong bảng sau:
Ô nguyên tố |
Tên nguyên tố |
Kí hiệu hóa học |
Số proton |
KLNT |
Số electron |
Chu kì |
Nhóm |
Loại nguyên tố |
6 |
Carbon |
C |
6 |
12 |
6 |
2 |
IVA |
Phi kim |
9 |
Fluorine |
F |
9 |
19 |
9 |
2 |
VIIA |
Phi kim |
19 |
Potassium |
K |
19 |
39 |
19 |
4 |
IA |
Kim loại |
b)
- Các nguyên tố Li, Na và K được xếp vào cùng một cột (cùng nhóm IA) vì cả 3 nguyên tố này đều có 1 electron ở lớp ngoài cùng.
- Tương tự, các nguyên tố O, S và Se được xếp vào cùng một cột (nhóm VIA) vì cả 3 nguyên tố đều có 6 electron ở lớp ngoài cùng.
c)
- Các nguyên tố B, C, O và F được xếp vào cùng 1 hàng (chu kì 2) vì cả 5 nguyên tố này đều có 2 lớp electron trong nguyên tử.
- Tương tự, các nguyên tố Na, Mg và Al được xếp vào cùng 1 hàng (chu kì 3) vì nguyên tử của các nguyên tố này đều có 3 lớp electron.
d)
Các nguyên tố He, Ne và Ar đều được xếp vào cùng một cột (nhóm VIIIA) vì cả hai nguyên tố Ne và Ar đều có 8 electron ở lớp ngoài cùng, còn nguyên tố He (đặc biệt) chỉ có 2 electron ở lớp ngoài cùng.
Số electron lớp ngoài cùng là 8 (riêng với He là 2) là cấu trúc bền vững và nhóm này còn có tên gọi là các nguyên tố khí hiếm.
Lời giải Sách bài tập Khoa học tự nhiên lớp 7 Bài 3: Sơ lược về bảng tuần hoàn các nguyên tố hóa học Cánh diều hay khác: