SBT Khoa học tự nhiên 7 trang 25 - Kết nối tri thức
Haylamdo biên soạn và sưu tầm lời giải SBT KHTN 7 trang 25 trong Bài 6: Giới thiệu về liên kết hóa học. Với lời giải chi tiết hy vọng sẽ giúp học sinh dễ dàng nắm được cách làm bài tập Sách bài tập KHTN 7.
Giải SBT Khoa học tự nhiên 7 trang 25 Kết nối tri thức
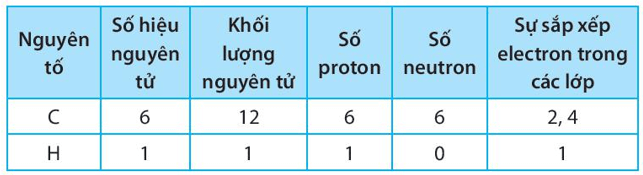
Bài 6.10 trang 25 sách bài tập KHTN 7: Điền các số thích hợp vào các ô còn trống để hoàn thành bảng sau:
Lời giải:
Bài 6.11 trang 25 sách bài tập KHTN 7: Hãy vẽ sơ đồ biểu diễn sự hình thành liên kết cộng hóa trị trong các phân tử sau, sử dụng các dấu chấm để biểu diễn các electron (tương tự như hình 6.5 trang 38 SGK):
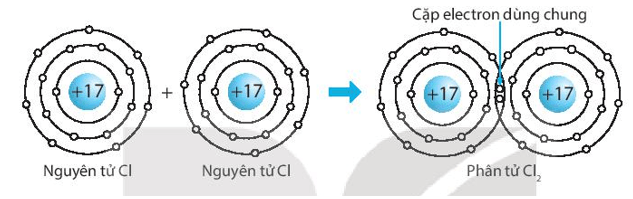
a) Chlorine, Cl2.
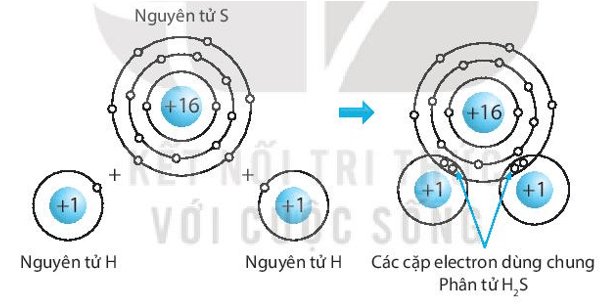
b) Hydrogen sulphide, H2S.
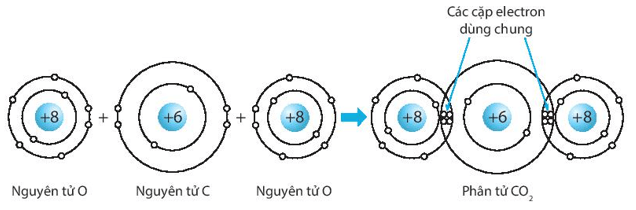
c) Carbon dioxide, CO2.
Lời giải:
a) Biểu diễn sự hình thành liên kết cộng hóa trị trong phân tử chlorine, Cl2:
b) Biểu diễn sự hình thành liên kết cộng hóa trị trong phân tử hydrogen sulphide, H2S:
c) Biểu diễn sự hình thành liên kết cộng hóa trị trong phân tử carbon dioxide, CO2:
Bài 6.12 trang 25 sách bài tập KHTN 7: Hãy giải thích các câu sau dựa trên tính chất của liên kết (ion hay cộng hóa trị) giữa các nguyên tử trong phân tử các chất.
a) Vì sao ammonia là chất khí ở nhiệt độ phòng.
b) Vì sao nhiệt độ nóng chảy của sodium chloride và iodine rất khác nhau? Nhiệt độ nóng chảy của chất nào cao hơn?
Lời giải:
a) Ammonia là hợp chất cộng hóa trị (liên kết giữa các nguyên tử N và H trong NH3 là liên kết cộng hóa trị), có nhiệt độ sôi thấp nên là chất khí ở nhiệt độ phòng.
b) Nhiệt độ nóng chảy của sodium chlorine và iodine là rất khác nhau vì sodium chloride (NaCl) là hợp chất ion còn iodine (I2) là hợp chất cộng hóa trị. Nhiệt độ nóng chảy của NaCl cao hơn.
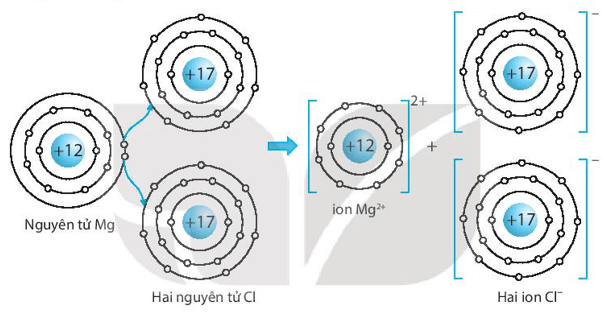
Bài 6.13 trang 25 sách bài tập KHTN 7: Đơn chất magnesium và đơn chất chlorine phản ứng với nhau tạo thành hợp chất magnesium chloride, là hợp chất có cấu trúc tinh thể.
a) Vẽ sơ đồ mô tả sự hình thành liên kết ion trong hợp chất MgCl2 từ các nguyên tử Mg và Cl (xem hình 6.2, trang 37 SGK). Cho biết số proton trong hạt nhân của Mg là 12 và của Cl là 17.
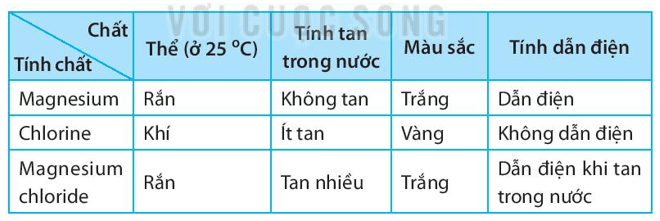
b) Lập bảng mô tả một số tính chất của đơn chất magnesium, đơn chất chlorine và hợp chất magnesium chloride. Các tính chất bao gồm:
(i) thể của chất ở nhiệt độ phòng (25oC).
(ii) tính tan trong nước (hoặc phản ứng với nước).
(iii) màu sắc.
(iv) tính dẫn điện.
Lời giải:
a) Sơ đồ mô tả sự hình thành liên kết ion trong hợp chất MgCl2 từ các nguyên tử Mg và Cl:
b) Bảng mô tả một số tính chất của đơn chất magnesium, đơn chất chlorine và hợp chất magnesium chloride: