Bài 43.1, 43.2, 43.3, 43.4, 43.5, 43.6, 43.7 trang 59 SBT Hóa học 8
Bài 43.1, 43.2, 43.3, 43.4, 43.5, 43.6, 43.7 trang 59 SBT Hóa học 8
Bài 43.1 trang 59 sách bài tập Hóa 8: Từ dung dịch MgSO4 2M làm thế nào pha chế được 100ml dung dịch MgSO4 0,4M?
Lời giải:
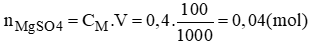
Thể tích dung dịch MgSO42M trong đó có thể hòa tan 0,04 mol MgSO4:
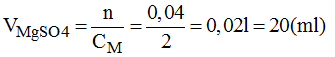
* Cách pha chế:
- Đong lấy 20ml dung dịch MgSO4 2M cho vào bình chứa.
- Cho thêm từ từ nước cất vào bình cho đủ 100ml. Lắc đều ta được 100ml dung dịch MgSO4 0,4mol/l.
Bài 43.2 trang 59 sách bài tập Hóa 8: Từ dung dịch NaCl 1M, hãy trình bày cách pha chế 250ml dung dịch NaCl 0,2M.
Lời giải:
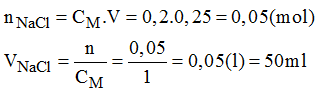
* Cách pha chế:
- Đong lấy 50ml dung dịch NaCl 1M cho vào bình chứa.
- Cho thêm từ từ nước cất vào bình cho đến đủ 250ml, lắc đều, ta được 250ml dung dịch NaCl 0,2M cần pha chế.
Bài 43.3 trang 59 sách bài tập Hóa 8: Hãy trình bày cách pha chế 150ml dung dịch HNO3 0,25M bằng cách pha loãng dung dịch HNO3 5M có sẵn.
Lời giải:
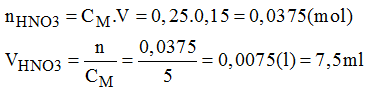
* Cách pha chế:
- Đong lấy 7,5ml dung dịch HNO3 5M cho vào bình chứa.
- Cho thêm dần dần nước cất vào bình cho đến đủ 150ml lắc đều, ta được 150m dung dịch HNO3 cần pha chế.
Bài 43.4 trang 59 sách bài tập Hóa 8: Từ glucozo (C6H12O6) vào nước cất, hãy trình bày cách pha chế 200g dung dịch glucozo 2%.
Lời giải:
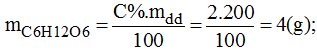
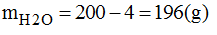
* Cách pha chế:
- Cân 4g glucozo cho vào bình chứa.
- Cho vào 196g nước cất, đổ vào bình đứng trên. Lắc mạnh cho C6H12O6 tan hết, ta được 200g dung dịch glucozo 2%.
Bài 43.5 trang 59 sách bài tập Hóa 8: Hãy trình bày cách pha chế các dung dịch theo những yêu cầu sau:
a) 250ml dung dịch có nồng độ 0,1M của những chất sau:
- NaCl;
- KNO3;
- CuSO4.
b) 200g dung dịch có nồng độ 10% của mỗi chất nói trên.
Lời giải:
n = CM.V = 0,1.0,25 = 0,025(mol)
* NaCl: mNaCl = n.M = 0,025.58,5 = 1,4625(g)
- Cách pha chế:
+ Cân lấy 1,4625g NaCl cho cốc và khuây nhẹ cho đủ 250ml dung dich. Ta được 250ml dung dịch NaCl 0,1M.
* KNO3: mKNO3 = n.M = 0,025.101 = 2,525(g)
- Cách pha chế:
+ Cân lấy 2,525g KNO3 cho vào cốc thủy tinh có dung tích 300ml. Đổ từ từ nước cất vào cốc và khuấy đều cho đến khi đủ 250ml dung dịch, ta được 250ml dung dịch KNO3 0,1M.
* CuSO4: mCuSO4 = 0,025.160 = 4(g)
- Cách pha chế: Cân lấy 4g CuSO4 cho vào bình chia độ có dung tích 300ml, đổ từ từ nước cất vào bình và khuấy nhẹ cho đến khi đủ 250ml dung dịch CuSO4 0,1M.
b)
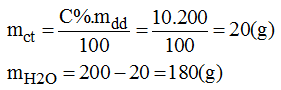
* NaCl: Cân lấy 20g NaCl cho vào bình tam giác. Cân lấy 180g nước cất rồi đổ dần dần vào cốc và khuấy nhẹ cho NaCl tan hết. Được 200g dung dịch NaCl 10%.
* KNO3: Cân lấy 20g KNO3 ch vào bình tam giác. Cân lấy 180g nước cất rồi đổ vào bình. Lắc mạnh cho HNO3 tan hết, ta dược 200g dung dịch KNO3 10%.
* CuSO4; Cân lấy 20g CuSO4 cho vào bình tam giác. Cân lây 180g nước cất rồi đổi vào bình. Lắc mạnh cho CuSO4 tan hết ta được 200g dung dịch CuSO4 10%.
Bài 43.6 trang 59 sách bài tập Hóa 8: Có những dung dịch ban đầu như sau:
a) NaCl 2M.
b) MgSO4 0,5M.
c) KNO3 4M.
Làm thế nào có thể pha chế được những dung dịch theo những yêu cầu sau:
- 500m dung dịch NaCl 0,5M
- 2 lit dung dịch MgSO4 0,2M
- 50ml dung dịch KNO3 0,2M.
Lời giải:
a) Pha chế 500ml dung dịch NaCl 0,5M từ dung dịch NaCl 2M
- Phần tính toán:
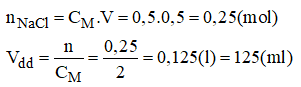
- Cách pha chế:
+ Đong lấy 125ml dung dịch NaCl 2M cho vào bình.
+ Thêm từ từ nước cất vào bình cho đủ 500ml, lắc đều, ta sẽ được 500ml dung dịch NaCl 0,5M cần pha chế.
b) Pha chế 2 lit dung dịch MgSO4 0,2M từ MgSO4 0,5M.

- Cách pha chế:
+ Đong lấy 800ml dung dịch MgSO4 0,5M đổ vào bình
+ Đổ từ từ nước cất vào bình cho được 2 lit, lắc đều, ta sẽ được 2 lit dung dịch MgSO4 0,2M cần pha chế.
c) Pha chế 50ml dung dịch KNO3 0,2M từ KNO3 4M.
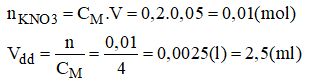
- Cách pha chế:
+ Đong lấy 2,5ml dung dịch KNO3 4M vào bình.
+ Đổ từ từ nước cất vào bình cho được 50ml, lắc đều, ta được 50ml dung dịch KNO3 0,2M cần pha chế.
Bài 43.7 trang 59 sách bài tập Hóa 8: Từ những muối và nước cất, hãy trình bày cách pha chế các dung dịch sau:
a) 2,5kg dung dịch NaCl 0,9%
b) 50g dung dịch MgCl2 4%
c) 250g dung dịch MgSO4 0,1%.
Lời giải:
a) 2,5kg dung dich NaCl 0,9%:
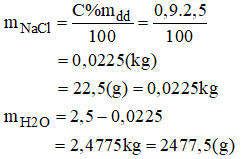
- Cách pha chế:
+ Cân lấy 22,5g NaCl tinh khiết cho vào chậu thủy tinh có dung tích khoảng 3 lit.
+ Đổ thêm 2477,5g nước cất vào chậu. Khuấy nhẹ cho muối tan hết, ta được 2,5kg dung dịch NaCl 0,9%.
b) 50g dung dịch MgCl2 4%:
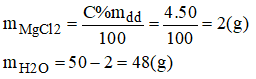
- Cách pha chế:
+ Cân lấy 2g MgCl2 tinh khiết cho vào bình chứa có dung tích khoảng 100ml.
+ Đổ thêm 48g nước cất vào bình. Khuấy nhẹ cho muối tan hết, ta được 50g dung dịch MgCl2 4%.
c) 250g dung dịch MgSO4 0,1%:
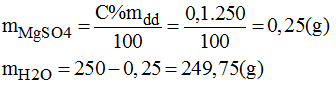
- Cách pha chế:
+ Cân lấy 0,25g MgSO4 tinh khiết cho vào bình chứa có dung tích khoảng 300ml.
+ Đổ thêm 249,75g nước cất vào bình, khuấy nhẹ cho muối tan hết. Ta được 250g dung dịch MgSO4 0,1%.

