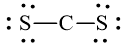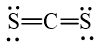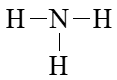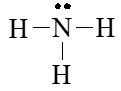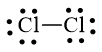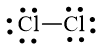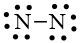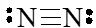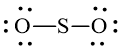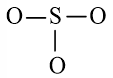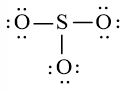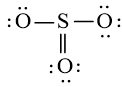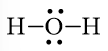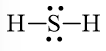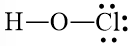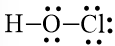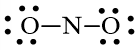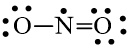Giải Chuyên đề Hóa học 10 Kết nối tri thức trang 7
Haylamdo biên soạn và sưu tầm lời Giải Chuyên đề Hóa học 10 trang 7 trong Bài 1: Liên kết hóa học sách Kết nối tri thức. Với lời giải hay nhất, chi tiết hy vọng sẽ giúp các học sinh dễ dàng nắm được cách làm bài tập Chuyên đề Hóa 10.
Chuyên đề Hóa học 10 trang 7 Kết nối tri thức
Câu hỏi 1 trang 7 Chuyên đề Hóa học 10: Công thức Lewis của CS2 là
Lời giải:
Đáp án đúng là: B
Tổng số electron hóa trị = 1.4 + 2.6 = 16 electron.
Trong phân tử CS2, nguyên tử C cần 4 electron để đạt octet, nguyên tử S cần 2 electron hóa trị để đạt octet. Vì vậy, C là nguyên tử trung tâm, còn các nguyên tử S được xếp quanh: S – C – S.
Mỗi nguyên tử S cần 6 electron hóa trị để đạt octet:
Số electron hóa trị còn lại = 16 – 2.2 – 2.6 = 0
Số electron hóa trị của nguyên tử C là 4 nên đạt octet mỗi nguyên tử S dùng 1 cặp electron hóa trị để tạo liên kết với nguyên tử C.
Công thức Lewis của CS2 là
Câu hỏi 2 trang 7 Chuyên đề Hóa học 10: Trình bày các bước để viết công thức Lewis của phân tử NH3.
Lời giải:
Bước 1. Tổng số electron hóa trị = 1.5 + 3.1 = 8 electron
Bước 2. Trong phân tử NH3, nguyên tử N cần 3 electron để đạt octet, nguyên tử H cần 1 electron hóa trị để đạt octet. Vì vậy, N là nguyên tử trung tâm, còn các nguyên tử H được xếp xung quanh:
Bước 3. Nguyên tử H đã đạt octet.
Bước 4. Số electron hóa trị còn lại là: 8 – 2.3 = 2
⇒ Chuyển 2 electron còn lại vào nguyên tử N để đạt octet, thu được công thức Lewis của phân tử NH3.
Câu hỏi 3 trang 7 Chuyên đề Hóa học 10: Viết các công thức Lewis cho mỗi phân tử sau:
a) Cl2; N2.
b) SO2; SO3.
c) H2O; H2S; HOCl.
Lời giải:
a) Công thức Lewis của Cl2 là:
Bước 1. Số electron hóa trị là 2.7 = 14 electron
Bước 2. Trong phân tử Cl2, mỗi nguyên tử Cl cần 1 electron để đạt octet.
Cl – Cl
Bước 3. Mỗi nguyên tử Cl cần 6 electron hóa trị để đạt octet:
Bước 4. Số electron hóa trị còn lại là: 14 – 6.2 – 2.1 = 0
Cả hai nguyên tử Cl đều đạt octet nên công thức Lewis của Cl2 là:
Công thức Lewis của N2 là:
Bước 1. Số electron hóa trị là 5.2 = 10 electron
Bước 2. Trong phân tử N2, mỗi nguyên tử N cần 3 electron để đạt octet.
N – N
Bước 3. Mỗi nguyên tử N cần 6 electron hóa trị để đạt octet:
Bước 4. Số electron hóa trị còn lại là: 10 – 6.2 – 2.1 = - 4
- Số electron hóa trị của nguyên tử N là 5, nên để đạt octet mỗi nguyên tử N sẽ góp chung 3 electron hóa trị để tạo liên kết với nhau.
Công thức Lewis của phân tử N2 là
b) Công thức Lewis của SO2 là:
Số electron hóa trị là 1.6 + 2.6 = 18 electron.
Trong phân tử SO2, nguyên tử S cần 2 electron để đạt octet, nguyên tử O cần 2 electron hóa trị để đạt octet. Vì vậy, S là nguyên tử trung tâm, còn nguyên tử O được xếp xung quanh: O – S – O.
Hoàn thiện octet cho nguyên tử O:
Số electron hóa trị còn lại: 18 – 2.2 – 2.6 = 2
Sử dụng 2 electron này để tạo octet cho S.
Nguyên tử S có 4 electron hóa trị nên 1 nguyên tử O sẽ dùng 1 cặp electron để tạo liên kết với S và nguyên tử S còn 1 đôi electron chưa tham gia liên kết.
Công thức Lewis của SO3 là:
- Viết công thức Lewis của SO3
Bước 1: S có 6 electron hóa trị, O có 6 electron hóa trị. Trong phân tử SO3, có 1 nguyên tử S và 3 nguyên tử O
⇒ Tổng số electron hóa trị = 1.6 + 3.6 = 24 electron
Bước 2: Vẽ khung tạo bởi các nguyên tử liên kết với nhau:
Bước 3: Mỗi nguyên tử O cần 6 electron để đạt octet.
Bước 4: Số electron hóa trị còn lại là: 24 – 2.3 – 6.3 = 0
Tuy nhiên S chưa đủ octet nên ta chuyển 1 cặp electron của nguyên tử O tạo thành cặp electron dùng chung.
chung.
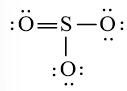
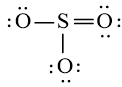
c) Công thức Lewis của H2O là:
Bước 1. Tổng số electron hóa trị là 1.2 + 1.6 = 8
Bước 2. Trong phân tử H2O, nguyên tử O cần 2 electron để đạt octet, nguyên tử H cần 1 electron hóa trị để đạt octet. Vì vậy, O là nguyên tử trung tâm, còn các nguyên tử H được xếp xung quanh. H – O – H.
Bước 3. Nguyên tử H đã đạt octet.
Bước 4. Số electron hóa trị còn lại là: 8 – 2.2 = 4
Nguyên tử O có 4 electron hóa trị nên sẽ chuyển 4 electron còn lại cho O để nguyên tử O đạt octet.
Công thức Lewis của H2O là:
Công thức Lewis của H2S là:
Bước 1. Tổng số electron hóa trị của phân tử = 1.2 + 1.6 = 8 electron
Bước 2. Trong phân tử H2S, nguyên tử S cần 2 electron để đạt octet, nguyên tử H cần 1 electron để đạt octet. Vì vậy, nguyên tử S là nguyên tử trung tâm, còn 2 nguyên tử H được xếp xung quanh: H – S – H
Bước 3. 2 nguyên tử H đã đạt octet.
Bước 4. Số electron hóa trị còn lại = 8 – 2.2 = 4
Nguyên tử S có 4 electron hóa trị nên để đạt octet thì chuyển 4 electron còn lại cho nguyên tử S.
Công thức Lewis của H2S là:
Công thức Lewis của HOCl là:
Bước 1. Tổng số electron hóa trị của phân tử = 1.1 + 1.6 + 1.7 = 14 electron.
Bước 2. Trong phân tử HOCl, nguyên tử Cl cần 1 electron để đạt octet, nguyên tử O cần 2 electron để đạt octet, nguyên tử H cần 1 electron để đạt octet. Vì vậy, O là nguyên tử trung tâm, nguyên tử H và Cl được xếp xung quang: H – O – Cl
Bước 3. Nguyên tử H đã đạt octet, nguyên tử Cl cần 7 electron hóa trị để đạt octet:
Bước 4: Số electron hóa trị còn lại: 14 – 2.2 – 1.6 = 4
Số electron hóa trị của O là 4, nên chuyển 4 electron còn lại vào nguyên tử O.
Công thức Lewis của HOCl là
Câu hỏi 4 trang 7 Chuyên đề Hóa học 1: Công thức Lewis biểu diễn cấu tạo của NO2 là
Lời giải:
Đáp án đúng là: C
Bước 1: Tổng số electron hóa trị trong phân tử = 1.5 + 2.6 = 17 electron
Bước 2: Trong phân tử NO2, nguyên tử N cần 3 electron để đạt octet, nguyên tử O cần 2 electron hóa trị để đạt octet. Vì vậy, N là nguyên tử trung tâm, còn các nguyên tử O được xếp xung quanh: O – N – O
Bước 3: Mỗi nguyên tử O cần 6 electron hóa trị để đạt octet:
Bước 4: Số electron hóa trị còn lại là 17 – 6.2 – 2.2 = 1
Mà nguyên tử N chưa đạt octet nên 1 nguyên tử O sẽ dùng 1 cặp electron hóa trị để tạo liên kết với nguyên tử N và trên nguyên tử N vẫn còn 1 electron chưa tham gia liên kết.
Công thức Lewis của NO2 là
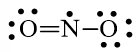
Lời giải bài tập Chuyên đề học tập Hóa học 10 Bài 1: Liên kết hóa học Kết nối tri thức hay khác: