Chia 100 g dung dịch muối có nồng độ 6,8% làm hai phần bằng nhau
SBT Hóa học 12 Bài 22: Luyện tập: Tính chất của kim loại
Giải bài 17 trang 52 SBT Hóa học 12 chi tiết trong bài học Bài 22: Luyện tập: Tính chất của kim loại giúp học sinh biết cách làm bài tập Hóa 12.
Bài 22.17 trang 52 Sách bài tập Hóa học 12: Chia 100 g dung dịch muối có nồng độ 6,8% làm hai phần bằng nhau.
- Phần một cho tác dụng với dung dịch NaOH dư, tạo ra một bazơ không tan, làm khô chất này thu được một oxit có khối lượng 2,32 g.
- Phần hai cho tác dụng với dung dịch NaCl dư thu được 2,87 g kết tủa không tan trong dung dịch axit.
a) Xác định công thức hoá học của muối có trong dung dịch ban đầu.
b) Trình bày các phương pháp hoá học điểu chế kim loại từ muối tìm được ở trên.
Lời giải:
a) Đặt công thức của muối là AmBn. Khối lượng mol của A, B là X, Y.
Khối lượng muối trong mỗi phần là 3,4 g. Ta có sơ đồ biến đổi các ch trong thí nghiệm 1:
2AmBn NaOH→ 2mA(OH)n to→ mA2On
Theo sơ đồ: 2(mX + nY) g AmBn tạo thành m(2X + 16n) g A2On.
Theo bài toán: 3,4 g AmBn →2,32 g A2On
Ta có phương trình: 3,4m(2X + 16n) = 2,32.2(mX + nY) (1)
Sơ đồ biến đổi các chất trong thí nghiệm 2:
AmBn NaCl→ mACln
Theo sơ đồ: (mX + nY) g AmBn tạo thành m(X + 35,5n) g ACln.
Theo bài toán: 3,4 g AmBn →2,87 g ACln
Ta có phương trình: 3,4m(X + 35,5n) = 2,87(mX + nY) (2)
Chia ( 1 ) cho (2) ta được
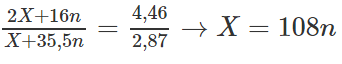
Giá trị có thể chấp nhận là n = 1 và X = 108. Vậy kim loại A là Ag.
Thay n = 1 và X = 108 vào (1) hoặc (2) ta có Y = 62m. Gốc axit trong m bạc không thể là gốc halogenua hoặc sunfua mà là gốc axit có oxi có khối lượng 62, gốc đó là NO3-
Vậy công thức hoá học của muối là AgNO3.
b) Điều chế Ag từ AgNO3:
Dùng kim loại mạnh hơn Ag để đẩy Ag: Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Nhiệt phân:
AgNO3 to→ Ag + NO2 + 1/2O2
Điện phân với điện cực trơ:
4AgNO3 + 2H2O đpdd→ 4Ag + O2 + 4HNO3

